Внутренняя энергия U реального газа определяется суммарной кинетической энергией его молекул 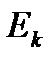 и суммарной потенциальной энергией их взаимодействия
и суммарной потенциальной энергией их взаимодействия 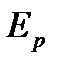 :
:
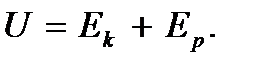
Выразим 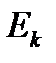 и
и 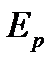 через макроскопические характеристики газа. В идеальном газе, где взаимодействием молекул на расстоянии пренебрегают, внутренняя энергия газа принимается равной суммарной кинетической энергии
через макроскопические характеристики газа. В идеальном газе, где взаимодействием молекул на расстоянии пренебрегают, внутренняя энергия газа принимается равной суммарной кинетической энергии 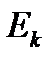 , поэтому можно предположить, что суммарная кинетическая энергия молекул реального газа будет определяться формулой, аналогичной формуле внутренней энергии идеального газа, т.е. будет пропорциональна температуре T. Поэтому для одного моля газа
, поэтому можно предположить, что суммарная кинетическая энергия молекул реального газа будет определяться формулой, аналогичной формуле внутренней энергии идеального газа, т.е. будет пропорциональна температуре T. Поэтому для одного моля газа 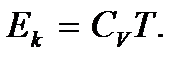 Взаимная потенциальная энергия молекул зависит от среднего расстояния между молекулами, и поэтому изменяется при изменении объема, занимаемого газом. Эту суммарную энергию взаимодействия молекул можно определить, если учесть, что при T = const, т.е. когда
Взаимная потенциальная энергия молекул зависит от среднего расстояния между молекулами, и поэтому изменяется при изменении объема, занимаемого газом. Эту суммарную энергию взаимодействия молекул можно определить, если учесть, что при T = const, т.е. когда 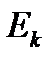 = const, работа, совершаемая при расширении газа против сил взаимного притяжения молекул друг к другу, равна приращению энергии взаимодействия:
= const, работа, совершаемая при расширении газа против сил взаимного притяжения молекул друг к другу, равна приращению энергии взаимодействия: 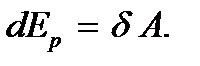 Учитывая это, будем иметь
Учитывая это, будем иметь
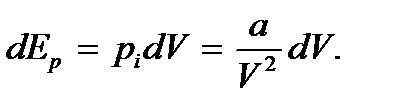
Интегрируя, получим
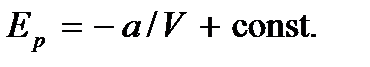
Приняв потенциальную энергию при 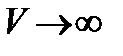 равной нулю, будем иметь
равной нулю, будем иметь
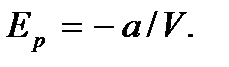
С учетом выражений для Ek и Ep для внутренней энергии реального газа получим
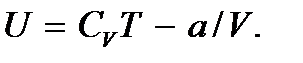
Таким образом, внутренняя энергия реального газа зависит не только от температуры, но и от объема газа. Заметим также, что, в отличие от идеального газа, температура реального газа может изменяться даже в том случае, если его внутренняя энергия остается постоянной. В случае, когда отсутствует обмен энергией между газом и внешней средой, внутренняя энергия его должна оставаться постоянной. Следовательно, в этом случае при изменении одного из параметров состояния (V или T) должно происходить соответствующее изменение и другого параметра. Значит, если заставить реальный газ адиабатически расширяться в вакуум (без совершения им работы против внешних сил), то его внутренняя энергия останется неизменной, а температура газа понизится. Действительно, в этом случае
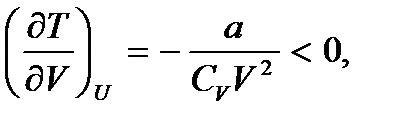
так что с увеличением объема газа V его температура T понижается. Впервые это явление было экспериментально исследовано Джоулем и Томсоном и носит название эффекта Джоуля – Томсона.
Эффект Джоуля – Томсона находит важное практическое применение в технике сжижения газов. Если предварительно достаточно охладить газ, а затем произвести процесс Джоуля – Томсона, то произойдет его дальнейшее охлаждение. Таким способом можно снизить температуру газа до температуры перехода его в жидкое состояние и тем самым произвести сжижение газа.
 2015-09-06
2015-09-06 8038
8038








