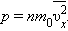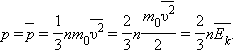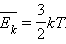Найпростішою моделлю молекулярно-кінетичної теорії є модель ідеального газу. У кінетичної моделі ідеального газу молекули розглядаються як ідеально пружні кульки, взаємодіючі між собою і зі стінками тільки під час пружних зіткнень. Сумарний обсяг усіх молекул передбачається малим у порівнянні з об'ємом посудини, в якому знаходиться газ. Модель ідеального газу достатньо добре описує поведінку реальних газів в широкому діапазоні тисків і температур.
Завдання молекулярно-кінетичної теорії полягає в тому, щоб встановити зв'язок між мікроскопічними (маса, швидкість, кінетична енергія молекул) і макроскопічними параметрами (тиск, газ, температура). В результаті кожного зіткнення між молекулами і молекул зі стінкою швидкості молекул можуть змінюватися по модулю і за напрямком; на інтервалах між послідовними зіткненнями молекули рухаються рівномірно і прямолінійно.
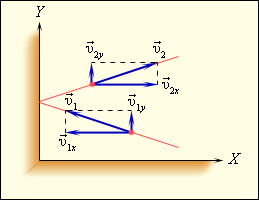
В моделі ідеального газу передбачається, що всі сутички відбуваються за законами пружного удару, тобто підкоряються законам механіки Ньютона. Використовуючи модель ідеального газу, обчислимо тиск газу на стінку посудини. В процесі взаємодії молекули зі стінкою судини між ними виникають сили, що підкоряються третьому закону Ньютона. В результаті проекція υx швидкості молекули, перпендикулярна стінці, змінює свій знак на протилежний, а проекція υy швидкості, паралельна стінці, залишається незмінною (рис. 3.2.1).
 1 1 |
| Малюнок 3.2.1. Пружне зіткнення молекули зі стінкою. |
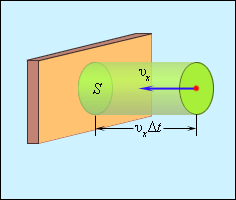
Тому зміна імпульсу молекули буде одно 2m0υx, де m0 - маса молекули. Виділимо на стінці деяку площадку S (рис. 3.2.2). За час Δt з цим майданчиком зіткнуться всі молекули, що мають проекцію швидкості υx, спрямовану в бік стінки, і знаходяться в циліндрі з основою площі S і висотою υxΔt.
 2 2 |
| Малюнок 3.2.2. Визначення числа зіткнень молекул з майданчиком S. |
Нехай в одиниці об'єму посудини містяться n молекул; тоді число молекул в об'ємі циліндра одно nSυxΔt. Але з цього числа лише половина рухається в бік стінки, а інша половина рухається в протилежному напрямку і зі стінкою не стикається. Отже, число ударів молекул об площадку S за час Δt одно 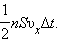 Оскільки кожна молекула при зіткненні зі стінкою змінює свій імпульс на величину 2m0υx, то повна зміна імпульсу всіх молекул, що зіткнулися за час Δt з майданчиком S, одно
Оскільки кожна молекула при зіткненні зі стінкою змінює свій імпульс на величину 2m0υx, то повна зміна імпульсу всіх молекул, що зіткнулися за час Δt з майданчиком S, одно 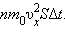 За законами механіки це зміна імпульсу всіх зіткнулися зі стінкою молекул відбувається під дією імпульсу сили FΔt, де F - деяка середня сила, що діє на молекули з боку стінки на майданчику S. Але по 3-му закону Ньютона така ж по модулю сила діє з боку молекул на площадку S. Тому можна записати:
За законами механіки це зміна імпульсу всіх зіткнулися зі стінкою молекул відбувається під дією імпульсу сили FΔt, де F - деяка середня сила, що діє на молекули з боку стінки на майданчику S. Але по 3-му закону Ньютона така ж по модулю сила діє з боку молекул на площадку S. Тому можна записати:
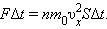 |
Розділивши обидві частини на SΔt, отримаємо:
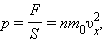 |
де p - тиск газу на стінку посудини. При виведенні цього співвідношення передбачалося, що всі n молекул, що містяться в одиниці об'єму газу, мають однакові проекції швидкостей на вісь X. Насправді це не так. В результаті численних зіткнень молекул газу між собою і зі стінками в посудині, що містить велику кількість молекул, встановлюється деякий статистичний розподіл молекул за швидкостями. При цьому всі напрями векторів швидкостей молекул виявляються рівноправними (рівно імовірними), а модулі швидкостей і їх проекції на координатні осі підпорядковуються певним закономірностям.
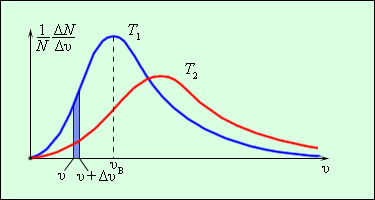
Розподіл молекул газу за модулем швидкостей називається розподілом Максвелла (1860 р.). Дж. Максвелл вивів закон розподілу молекул газу за швидкостями, виходячи з основних положень молекулярно-кінетичної теорії. На рис. 3.2.3 представлені типові криві розподілу молекул за швидкостями. По осі абсцис відкладений модуль швидкості, а по осі ординат - відносне число молекул, швидкості яких лежать в інтервалі від υ до υ + Δυ. Це число дорівнює площі виділеного на рис. 3.2.3 стовпчика.
 3 3 |
| Малюнок 3.2.3. Розподіл молекул за швидкостями. T2> T1. |
Характерними параметрами розподілу Максвелла є найбільш ймовірна швидкість υв, відповідна максимуму кривої розподілу, і середньоквадратична швидкість 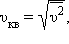 де
де 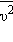 - середнє значення квадрата швидкості. З ростом температури максимум кривої розподілу зміщується в бік більших швидкостей, при цьому υв і υкв збільшуються. Щоб уточнити формулу для тиску газу на стінку посудини, припустимо, що всі молекули, що містяться в одиниці об'єму, розбиті на групи, які містять n1, n2, n3 і т. д. молекул з проекціями швидкостей υx1, υx2, υx3 і т. д. відповідно. При цьому
- середнє значення квадрата швидкості. З ростом температури максимум кривої розподілу зміщується в бік більших швидкостей, при цьому υв і υкв збільшуються. Щоб уточнити формулу для тиску газу на стінку посудини, припустимо, що всі молекули, що містяться в одиниці об'єму, розбиті на групи, які містять n1, n2, n3 і т. д. молекул з проекціями швидкостей υx1, υx2, υx3 і т. д. відповідно. При цьому 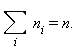 Кожна група молекул вносить свій внесок
Кожна група молекул вносить свій внесок 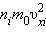 в тиск газу. В результаті зіткнень зі стінкою молекул з різними значеннями проекцій υxi швидкостей виникає сумарний тиск
в тиск газу. В результаті зіткнень зі стінкою молекул з різними значеннями проекцій υxi швидкостей виникає сумарний тиск
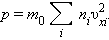 |
Вхідна в цей вираз сума - це сума квадратів проекцій υx всіх n молекул в одиничному об'ємі
газу. Якщо цю суму розділити на n, то ми отримаємо середнє значення 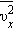 квадрата проекції
квадрата проекції 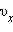 швидкості молекул:
швидкості молекул:
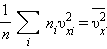 |
Тепер формулу для тиску газу можна записати у вигляді
|
Так як всі напрямки для векторів швидкостей молекул рівно ймовірно, середнє значення квадратів їх проекцій на координатні осі рівні між собою:
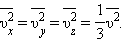 |
Останнє рівність випливає з формули: 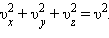 Формула для середнього тиску газу на стінку посудини запишеться у вигляді
Формула для середнього тиску газу на стінку посудини запишеться у вигляді
|
Це рівняння встановлює зв'язок між тиском p ідеального газу, масою молекули m0, концентрацією молекул n, середнім значенням квадрата швидкості 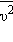 і середньої кінетичної
і середньої кінетичної
енергією 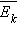 поступального руху молекул. Його називають основним рівнянням молекулярно-кінетичної теорії газів. Таким чином, тиск газу дорівнює двом третинам середньої кінетичної енергії поступального руху молекул, що містяться в одиниці об'єму. В основне рівняння молекулярно-кінетичної теорії газів входить добуток концентрації молекул n на середню кінетичну енергію
поступального руху молекул. Його називають основним рівнянням молекулярно-кінетичної теорії газів. Таким чином, тиск газу дорівнює двом третинам середньої кінетичної енергії поступального руху молекул, що містяться в одиниці об'єму. В основне рівняння молекулярно-кінетичної теорії газів входить добуток концентрації молекул n на середню кінетичну енергію 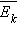 поступального руху. Якщо припустити, що газ знаходиться в посудині незмінного об'єму V, то
поступального руху. Якщо припустити, що газ знаходиться в посудині незмінного об'єму V, то 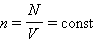 (N - число молекул в посудині). У цьому
(N - число молекул в посудині). У цьому
випадку зміна тиску Δp пропорційно зміні 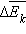 середньої кінетичної енергії. Виникають питання: яким чином можна на досвіді змінювати середню кінетичну енергію руху молекул в посудині незмінного обсягу? Яку фізичну величину потрібно змінити, щоб змінилася середня кінетична енергія
середньої кінетичної енергії. Виникають питання: яким чином можна на досвіді змінювати середню кінетичну енергію руху молекул в посудині незмінного обсягу? Яку фізичну величину потрібно змінити, щоб змінилася середня кінетична енергія 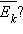 Такий величиною у фізиці є температура. Поняття температури тісно пов'язане з поняттям теплової рівноваги. Тіла, що знаходяться в контакті один з одним, можуть обмінюватися енергією. Енергія, що передається одним тілом іншому при тепловому контакті, називається кількістю теплоти. Теплове рівновагу - це такий стан системи тіл, що знаходяться в тепловому контакті, при якому не відбувається теплопередачі від одного тіла до іншого, і всі макроскопічні параметри тел залишаються незмінними. Температура - це фізичний параметр, однаковий для всіх тіл, що знаходяться в тепловій рівновазі. Можливість введення поняття температури випливає з досвіду і носить назву нульового закону термодинаміки.
Такий величиною у фізиці є температура. Поняття температури тісно пов'язане з поняттям теплової рівноваги. Тіла, що знаходяться в контакті один з одним, можуть обмінюватися енергією. Енергія, що передається одним тілом іншому при тепловому контакті, називається кількістю теплоти. Теплове рівновагу - це такий стан системи тіл, що знаходяться в тепловому контакті, при якому не відбувається теплопередачі від одного тіла до іншого, і всі макроскопічні параметри тел залишаються незмінними. Температура - це фізичний параметр, однаковий для всіх тіл, що знаходяться в тепловій рівновазі. Можливість введення поняття температури випливає з досвіду і носить назву нульового закону термодинаміки.
Для вимірювання температури використовуються фізичні прилади - термометри, в яких про величину температури судять по зміні якого-небудь фізичного параметра. Для створення термометра необхідно вибрати термометрична речовина (наприклад, ртуть, спирт) і термометричних величину, що характеризує властивість речовини (наприклад, довжина ртутного чи спиртового стовпчика). У різних конструкціях термометрів використовуються різноманітні фізичні властивості речовини (наприклад, зміна лінійних розмірів твердих тіл або зміна електричного опору провідників при нагріванні).
Термометри повинні бути відкалібровані. Для цього їх наводять в тепловий контакт з тілами, температури яких вважаються заданими. Найчастіше використовують прості природні системи, в яких температура залишається незмінною, незважаючи на теплообмін з навколишнім середовищем - це суміш льоду і води і суміш води і пари при кипінні при нормальному атмосферному тиску. За температурною шкалою Цельсія точці плавлення льоду приписується температура 0 ° С, а точки кипіння води - 100 ° С. Зміна довжини стовпа рідини в капілярах термометра на одну соту довжини між відмітками 0 ° С і 100 ° С приймається рівним 1 ° С. У ряді країн (США) широко використовується шкала Фаренгейта (TF), в якій температура замерзлої води приймається рівною 32 ° F, а температура кипіння води рівний 212 ° F. Отже,
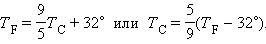 |
Особливе місце у фізиці займають газові термометри (мал. 3.2.4), в яких термометричною речовиною є розріджений газ (гелій, повітря) в посудині незмінного обсягу (V = const), а термометрической величиною - тиск газу p. Досвід показує, що тиск газу (при V = const) зростає із зростанням температури, виміряної за шкалою Цельсія.
 4 4 |
| Малюнок 3.2.4. Газовий термометр з постійним об'ємом. |
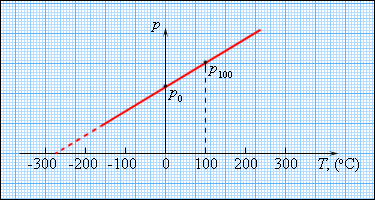
Щоб проградуювати газовий термометр постійного об'єму, можна виміряти тиск при двох значеннях температури (наприклад, 0 ° C і 100 ° C), нанести точки p0 і p100 на графік, а потім провести між ними пряму лінію (мал. 3.2.5)використовуючи отриманий таким чином калібрувальний графік, можна визначати температури, відповідні іншим значенням тиску. Екстраполюючи графік в область низьких тисків, можна визначити деяку «гіпотетичну» температуру, при якій тиск газу стало б рівним нулю. Досвід показує, що ця температура дорівнює -273,15 ° С і не залежить від властивостей газу. Неможливо на досвіді отримати шляхом охолодження газ в змозі з нульовим тиском, так як при дуже низьких температурах всі гази переходять в рідкі або тверді стану.
 5 5 |
| Малюнок 3.2.5. Залежність тиску газу від температури при V = const. |
Англійський фізик У. Кельвін (Томсон) в 1848 р. запропонував використовувати точку нульового тиску газу для побудови нової температурної шкали (шкала Кельвіна). У цій шкалі одиниця вимірювання температури така ж, як і в шкалі Цельсія, але нульова точка зрушена:
| Tк = TС + 273,15. |
В системі СІ прийнято одиницю виміру температури за шкалою Кельвіна називати Кельвіном і позначати буквою К. Наприклад, кімнатна температура TС = 20 ° С за шкалою Кельвіна дорівнює tк = 293,15 К. Температурна шкала Кельвіна називається абсолютною шкалою температур. Вона виявляється найбільш зручною при побудові фізичних теорій. Немає необхідності прив'язувати шкалу Кельвіна до двох фіксованим точкам - точці плавлення льоду і точки кипіння води при нормальному атмосферному тиску, як це прийнято в шкалі Цельсія. Крім точки нульового тиску газу, яка називається абсолютним нулем температури, достатньо прийняти ще одну фіксовану опорну точку.
В шкалою Кельвіна в якості такої точки використовується температура потрійної точки води (0,01 ° С), в якій в тепловій рівновазі знаходяться всі три фази - лід, вода і пар. За шкалою Кельвіна температура потрійної точки приймається рівною 273,16 К. Газові термометри громіздкі і незручні для практичного застосування: вони використовуються як прецизійного стандарту для калібрування інших термометрів. Таким чином, тиск розрідженого газу в посудині постійного об'єму V змінюється прямо пропорційно його абсолютній температурі: p ~ T. З іншого боку, досвід показує, що при незмінних обсязі V і температурі T тиск газу змінюється прямо пропорційно відношенню кількості речовини ν в даному посудині до обсягу V судини
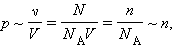 |
де N - число молекул в посудині, NА - постійна Авогадро, n = N / V - концентрація молекул (тобто число молекул в одиниці об'єму посудини). Об'єднуючи ці співвідношення пропорційності, можна записати:
|
де k - деяка універсальна для всіх газів постійна величина. Її називають постійної Больцмана, в честь австрійського фізика Л. Больцмана (1844-1906 рр..), одного з творців молекулярно-кінетичної теорії. Постійна Больцмана - одна з фундаментальних фізичних констант. Її чисельне значення в СІ одно:
| k = 1,38 · 10-23 Дж / К. |
Порівнюючи співвідношення p = nkT з основним рівнянням молекулярно-кінетичної теорії газів, можна отримати:
|
Середня кінетична енергія хаотичного руху молекул газу прямо пропорційна абсолютній температурі. Таким чином, температура є мірою середньої кінетичної енергії поступального руху молекул. Слід звернути увагу на те, що середня кінетична енергія поступального руху молекули не залежить від її маси. Броунівська частинка, зважена в рідині або газі, володіє такою ж середньої кінетичної енергією, як і окрема молекула, маса якої на багато порядків менше маси броунівський частинки. Цей висновок поширюється і на випадок, коли в посудині знаходиться суміш хімічно не взаємодіючих газів, молекули яких мають різні маси. У стані рівноваги молекули різних газів будуть мати однакові середні кінетичні енергії теплового руху, що визначаються тільки температурою суміші. Тиск суміші газів на стінки посудини буде складатися з парціальних тисків кожного газу:
|
У цьому співвідношенні n1, n2, n3,... - концентрації молекул різних газів у суміші. Це співвідношення виражає на мові молекулярно-кінетичної теорії експериментально встановлений на початку XIX сторіччя закон Дальтона: тиск в суміші хімічно не взаємодіючих газів дорівнює сумі їх парціальних тисків.
 2015-09-06
2015-09-06 1819
1819