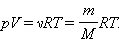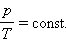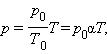Співвідношення
| p = nkT, |
зв’язуючи тиск газу з його температурою і концентрацією молекул, отримано в §3.2 для моделі ідеального газу, молекули якого взаємодіють між собою і із стінками судини лише під час пружних зіткнень. Це співвідношення може бути записане в іншій формі, що встановлює зв'язок між макроскопічними параметрами газу, – обємом V, тиском p, температурою T і кількістю речовини?. Для цього потрібно використовувати рівність
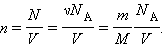 |
Тут N – число молекул в судині, NА – постійна Авогадро, m – маса газу в судині, M – молярна маса газу. У результаті отримаємо:
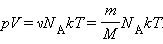 |
Твір постійною Авогадро NА на постійну Больцмана до називається універсальною газовою постійною і позначається буквою R. Її чисельне значення в СІ є:
| R = 8,31 Дж/моль· К. |
Співвідношення
| (*) |
називається рівнянням стану ідеального газу. Для одного моля будь-якого газу це співвідношення приймає вигляд:
|
Якщо температура газу рівна Tн = 273,15 До (0 °С), а тиск pн = 1 атм = 1,013•105 Па, то говорять, що газ знаходиться за нормальних умов. Як випливає з рівняння стану ідеального газу, один моль будь-якого газу при нормальних умовах займає один і той же об'єм V0, рівний
| V0 = 0,0224 м3/моль = 22,4 дм3/моль. |
Це твердження називається законом Авогадро. Для суміші не взаємодіючих газів рівняння стану приймає вигляд
|
де v1, v2, v3 і так далі – кількість речовини кожного із газів в суміші. Рівняння, що встановлює зв'язок між тиском, об'ємом і температурою газу було отримане в середині XIX століття французьким фізиком Б. Клапейроном, у формі (*) воно було вперше записане Д. І. Менделєєвим. Тому рівняння стану газу називається рівнянням Клапейрона–Менделєєва. Слід зазначити, що задовго до того, як рівняння стану ідеального газу було теоретично отримане на основі молекулярно - кінетичної моделізакономерності поведінки газів в різних умовах були добре вивчені експериментально. Тому рівняння (*) можна розглядати як узагальнення дослідних фактів, які знаходять пояснення в молекулярно-кінетичній теорії. Газ може брати участь в різних теплових процесах, при яких можуть змінюватися всі параметри, що описують його стан (p, V і T). Якщо процес протікає досить повільний, то у будь-який момент система близька до свого рівноважному стану. Такі процеси називаються квазістатічеськимі. У звичному для нас масштабі часу ці процеси можуть протікати і не дуже повільно.
Наприклад, розрідження і стискування газу в звуковій хвилі, сотні разів, що відбуваються, в секунду, можна розглядати як квазістатичний процес. Квазістатичні процеси можуть бути змальовані на діаграмі станів(наприклад, в координатах p, V) у вигляді деякої траєкторії, кожна точка якої представляє рівноважний стан. Інтерес представляють процеси, в яких один з параметрів (p, V або T) залишається незмінним. Такі процеси називаються ізопроцессамі.
Ізотермічний процес (T = const)
Ізотермічним процесом називають квазістатичний процес, що протікає при постійній температурі T. З рівняння стану ідеального газу виходить, що при постійній температурі T і незмінній кількості речовини? у судині твір тиску p газу на його об'єм V повинен залишатися постійним:
|
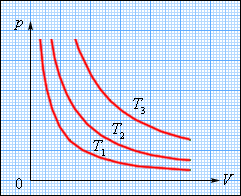
На плоскості (p, V) ізотермічні процеси зображуються при різних значеннях температури T сімейством гіпербол p ~ 1 / V, які називаються ізотермами. Оскільки коефіцієнт пропорційності в цьому співвідношенні збільшується із зростанням температури, ізотерми, відповідні вищим значенням температури, розташовуються на графіці вище за ізотерми, відповідні меншим значенням температури (мал. 3.3.1). Рівняння ізотермічного процесу було отримане з експерименту англійським фізиком Р. Бойлем (1662 р.) і незалежно французьким фізиком Е. Маріоттом (1676 р.). Тому це рівняння називають законом Бойля–Маріотта.
 1 1 |
| Рисунок 3.3.1. Сімейство ізотерм на плоскості (p, V). T3 > T2 > T1. |
Ізохорний процес (V = const)
Ізохорний процес – це процес квазістатичного нагрівання або охолоджування газу при постійному об'ємі V і за умови, що кількість речовини? у судині залишається незмінним. Як випливає з рівняння (*) стану ідеального газу, за цих умов тиск газу p змінюється прямо пропорціональна його абсолютній температурі: p ~ T або
|
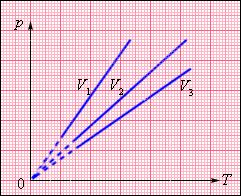
На плоскості (p, T) ізохорні процеси для заданої кількості речовини? при різних значеннях об'єму V зображаються сімейством прямих ліній, які називаються ізохорами. Великим значенням об'єму відповідають ізохори з меншим нахилом по відношенню до осі температур (мал. 3.3.2).
 2 2 |
| Рисунок 3.3.2. Сімейство ізотерм на плоскості (p, T). V3 > V2 > V1. |
Експериментально залежність тиску газу від температури досліджував французький фізик Ж. Шарль (1787 р.). Тому рівняння ізохорного процесу називається законом Шарля. Рівняння ізохорного процесу може бути записане у вигляді:
|
де p0 – тиск газу при T = T0 = 273,15 До (тобто при температурі 0 °С). Коефіцієнт α, рівний 1/273,15 К–1, називають температурним коефіцієнтом тиску.
Ізобарний процес (p = const)
Ізобарним процесом називають квазістатичний процес, що протікає при незмінним тиску р. Рівняння ізобарного процесу для деякої незмінної кількості речовини ν має вигляд:
|
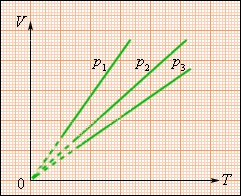
де V0 – об'єм газу при температурі 0 °С. Коефіцієнт α рівний 1/273,15 К–1. Його називають температурним коефіцієнтом об'ємного розширення газів. На плоскості (V, T) ізобарні процеси при різних значеннях тиску p зображуються сімейством прямих ліній (мал. 3.3.3), які називаються ізобарами.
 3 3 |
| Рисунок 3.3.3. Сімейство ізотерм на плоскості (V, T). p3 > p2 > p1. |
Залежність об'єму газу від температури при незмінному тиску була експериментально досліджена французьким фізиком Ж. Гей-Люссаком (1862 р.). Тому рівняння ізобарного процесу називають законом Гей-Люссака. Експериментально встановлені закони Бойля–Маріотта, Шарля і Гей-Люссака знаходять пояснення в молекулярно-кінетичній теорії газів. Вони є наслідком рівняння стану ідеального газу.
 2015-09-06
2015-09-06 1749
1749