Для определения уровней энергии и волновых функций при колебаниях молекулы необходимо решить уравнение Шредингера вида
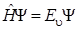 . (4.21)
. (4.21)
Запись указанного уравнения для i -го нормального колебания будет иметь следующий вид:
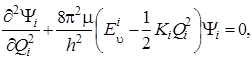 (4.22)
(4.22)
причем
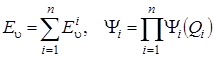 . (4.23)
. (4.23)
Формула (4.22) представляет собой известное волновое уравнение для линейного гармонического осциллятора (здесь имеется в виду, что любое i -е нормальное колебание совершается по гармоническому закону). Значения энергии гармонического осциллятора определяются выражением
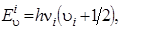 (4.24)
(4.24)
u i = 0, 1, 2, 3,..., n; u i – колебательное квантовое число;n i – классическая частота (в с–1) i -го нормального колебания.
Частота света, поглощаемого или излучаемого молекулой, равна
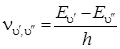 . (4.25)
. (4.25)
Переход из основного состояния (все u² = 0) в состояние, в котором u i ¢ = 1, a все остальные u i ¢(i ¹ k) равны нулю, соответствует поглощению частоты n k., являющейся частотой k -го нормального колебания. Согласно правилам отбора для гармонического осциллятора в испускании и поглощении возможны лишь переходы с изменением квантового числа
u k на ±1.
Таким образом, имеется важное соответствие между результатами квантовой и классической теорий. Для гармонического осциллятора частота квантового перехода между соседними колебательными уровнями в соответствии с правилами отбора совпадает с классической частотой колебаний. Поэтому в гармоническом приближении задача о нормальных колебаниях молекулы может решаться методами классической механики. На рис.4.1 приведены уровни энергии трехатомной молекулы воды.
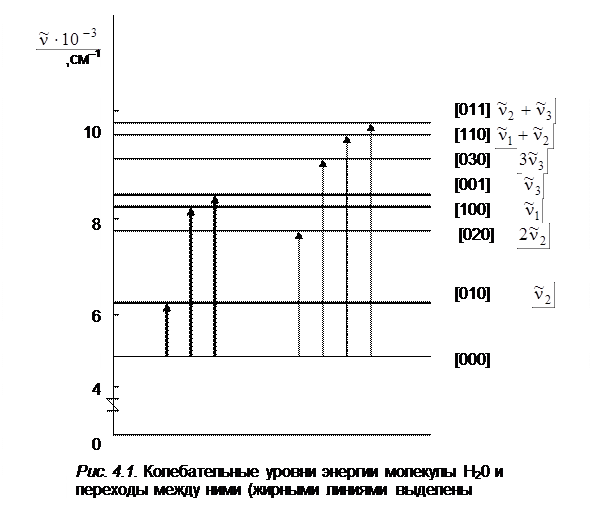
Она имеет три колебательные степени свободы и характеризуется тремя нормальными колебаниями 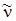 1= 3657 см–1,
1= 3657 см–1, 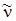 2.= 1595см–1и
2.= 1595см–1и
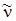 3 = 3756 см–1. Если все u i = 0, то мы, согласно (4.24), получаем нулевую энергию колебаний
3 = 3756 см–1. Если все u i = 0, то мы, согласно (4.24), получаем нулевую энергию колебаний 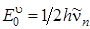 (где n = 1, 2, 3), равную 4504 см –1. Основные уровни энергии проведены более жирными линиями, а обертонные и составные уровни – более тонкими линиями. Переходы на составные и обертонные уровни возможны при учете ангармонизма колебаний. Для колебаний многоатомной молекулы, так же как и для двухатомной, нужно учитывать ангармоничность, проявляющуюся тем сильнее, чем больше колебательная энергия, приходящаяся на отдельные нормальные колебания. Ангармоничность обусловлена отличием реальных сил в молекуле от квазиупругих. В связи с этим и потенциальная энергия молекулы не является чисто квадратичной функцией. С учетом ангармоничности колебаний энергия молекулы будет определяться формулой:
(где n = 1, 2, 3), равную 4504 см –1. Основные уровни энергии проведены более жирными линиями, а обертонные и составные уровни – более тонкими линиями. Переходы на составные и обертонные уровни возможны при учете ангармонизма колебаний. Для колебаний многоатомной молекулы, так же как и для двухатомной, нужно учитывать ангармоничность, проявляющуюся тем сильнее, чем больше колебательная энергия, приходящаяся на отдельные нормальные колебания. Ангармоничность обусловлена отличием реальных сил в молекуле от квазиупругих. В связи с этим и потенциальная энергия молекулы не является чисто квадратичной функцией. С учетом ангармоничности колебаний энергия молекулы будет определяться формулой:
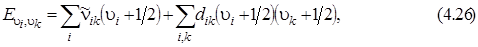
содержащей наряду с линейными членами и квадратичные. величина ангармоничности dik выражается в см–1. Формула (4.26) отличается от аналогичной формулы для двухатомной молекулы тем, что она содержит не только диагональные члены типа dii (u i + 1/2)2, но и недиагональные – типа dik (u i + 1/2)(u k + 1/2), характеризующие взаимное влияние нормальных колебании. При наличии ангармоничности каждое нормальное колебание не только изменяется, но и перестает быть независимыми друг от друга.
коэффициенты dik малы по сравнению с частотами 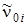 ,отношение
,отношение 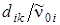 составляет несколько сотых, как и для двухатомных молекул.
составляет несколько сотых, как и для двухатомных молекул.
Учет ангармоничности для многоатомных молекул представляет довольно трудную задачу, которая может быть решена для простейших многоатомных молекул. Он наиболее существен для молекул, содержащих атомы водорода (углеводороды, вода и др.).
Вследствие ангармоничности частоты переходов u i = 0®u i = 1, соответствующих отдельным нормальным колебаниям, не совпадают с нулевыми частотами n0 k гармонических колебаний. Нулевая энергия колебаний равна
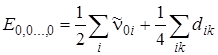 (4.27)
(4.27)
и частота перехода ni = 0®ni = 1 составляет
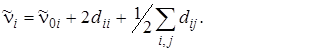 (4.28)
(4.28)
В последней формуле (4.28) коэффициент dii характеризует ангармоничность данного колебания, а коэффициенты dij (i ¹ j) – связи различных нормальных колебаний, обусловленные ангармоничностью.
Для случая нелинейной трехатомной молекулы частоты переходов будут выражаться следующим образом:
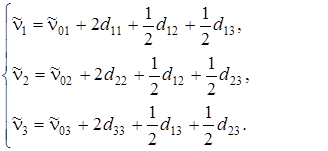 (4.29)
(4.29)
Для молекулы воды разница наблюдаемых n i и нулевых частот n0 i, оказывается весьма заметной
n1 = 3657 см–1, n2 = 1595 см–1, n3 = 3756 см–1,
n01 = 3825,3 см–1; n02 = 1653,9 см–1; n03 = 3965,6 см–1.
С учетом ангармоничности правила отбора по колебательному квантовому числу Du i = ±1 для гармонического осциллятора нарушаются. Оказываются возможными переходы с êDu i ê> 1, которым соответствуют обертоны и составные частоты, получающиеся при одновременном изменении квантовых чисел двух или нескольких колебаний. Поэтому, как видно на рис. 4.1, в молекуле воды наряду с основными переходами (переходы с нулевого колебательного уровня)
[0 0 0] ® [1 0 0]; [0 0 0] ® [0 1 0]; [0 0 0] ® [0 0 1] – 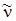 1,
1, 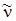 2,
2, 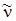 3 основные частоты;
3 основные частоты;
можно наблюдать обертоны:
[2 0 0]; [0 2 0]; [0 0 2]; – первый обертон – 2 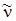 1, 2
1, 2 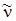 2, 2
2, 2 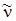 3,
3,
[3 0 0]; [0 3 0]; [0 0 3] – второй обертон –3 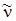 1, 3
1, 3 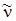 2, 3
2, 3 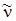 3,
3,
составные частоты:
[1 1 0]; [1 0 1]; [0 1 1] – 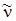 1+
1+ 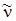 2,
2, 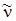 1+
1+ 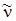 3,
3, 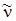 2+
2+ 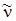 3,
3,
[2 1 0]; [2 0 1]; [1 2 0] и др.
Таким образом, получается большое число возможных переходов. На опыте классифицировать основные колебания и их обертоны или составные частоты сравнительно легко, так как интенсивность их значительно меньше основных колебаний.
В спектрах поглощения существенное значение имеют переходы, связанные с основным состоянием, так как при нормальных условиях большинство молекул находится в основном состоянии. Однако могут встречаться и переходы из возбужденных состояний в состояния с большей энергией. соответствующие частоты будут называться разностными частотами.
 2015-09-06
2015-09-06 636
636








