При операциях симметрии эквивалентные связи и углы в молекулах переходят друг в друга. Например, в молекуле аммиака NH3 имеются три эквивалентных угла g HNH и три эквивалентные связи N–H. Изменения длин эквивалентных связей и углов называются эквивалентными естественными координатами.
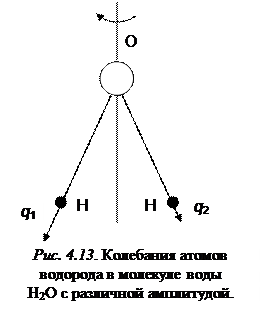 В результате колебаний смещенная конфигурация молекулы уже не обладает в общем случае симметрией, поэтому эквивалентные координаты при операциях симметрии не преобразуются друг в друга, как это видно из примера на рис 4.13.
В результате колебаний смещенная конфигурация молекулы уже не обладает в общем случае симметрией, поэтому эквивалентные координаты при операциях симметрии не преобразуются друг в друга, как это видно из примера на рис 4.13.
При осуществлении операции поворота вокруг оси 2-го порядка смещение q 1 уже не переходит в смещение q 2. Это вызывает неудобства в анализе колебаний при использовании операций симметрии. Поэтому поступают следующим образом: вводят новые координаты симметрии, которые являются линейными комбинациями естественных координат, что позволяет упростить задачу анализа колебаний молекулы. Любые два произвольных смещения q 1 и q 2 в молекуле всегда можно разложить на симметричные смещения (оба атома смещаются на величину 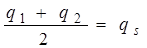 ) и на антисимметричные, где один атом смещается на величину
) и на антисимметричные, где один атом смещается на величину 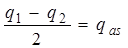 , а другой атом – на
, а другой атом – на 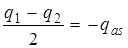 (рис. 4.14).
(рис. 4.14).
В результате мы имеем смещения
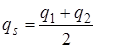 и
и 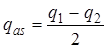 . (4.69)
. (4.69)
Из соотношения (4.69) видно, что исходные координаты qi и q 2 выразятся через симметричную и антисимметричную координаты по формулам:
q 1 = qs + qas, q 2 = qs – qas.
Отметим, что координаты (4.69) являются ортогональными
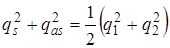 .
.
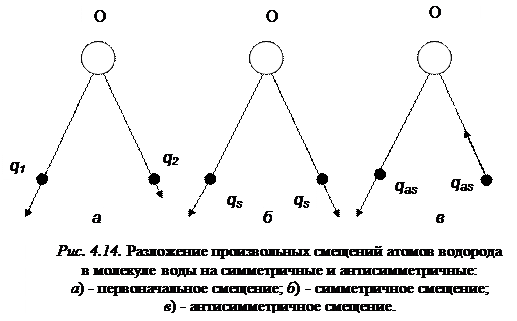
Их в конечном итоге можно выбрать нормированными, т. е. так, чтобы 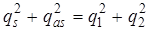 . Для этого нужно положить
. Для этого нужно положить
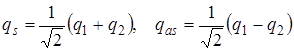 . (4.70)
. (4.70)
С другой стороны, естественные координаты (смещения) выразятся из (4.70) следующим образом:
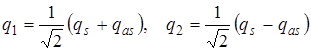 . (4.71)
. (4.71)
В итоге для молекулы воды Н2О получаем вместо трех естественных координат q 1, q 2 и q 3a три новые координаты – две симметричные, не меняющие знака при повороте,
q's = qs, a¢s = as (4.72)
и одну антисимметричную, изменяющую знак при этой операции
q'аs = – qas. (4.73)
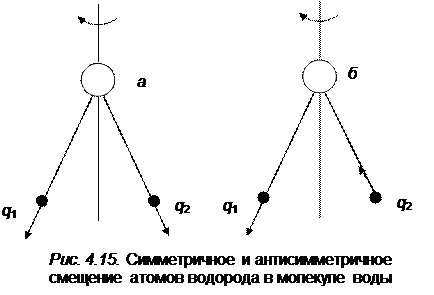
Для изменения длин связи введем два типа координат симметрии:
A – симметричные (изменения длин всех эквивалентных связей одинаковы);
B – антисимметричные (изменения длин эквивалентных связей одинаковы по величине, но обратные по знаку).
На рис.4.15 показан пример для трехатомной молекулы.
При операциях симметрии координаты симметрии с точностью до знака сохраняются. Действительно, (см. рис. 4.15) при повороте вокруг оси С 2 координата q 1 переходит в q 2, а q 2 в q 1. При равенстве этих координат в молекуле ничего не изменяется. В случае б на рис. 4.15 координата q 1 переходит в – q 2, a q 2 в – q 1. При таком выборе координат симметрии довлетворяется условие, при котором энергия молекулы не зависит от операции симметрии.
В общем случае преобразование координат от естественных к координатам симметрии дается линейным преобразованием вида
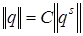 (4.74)
(4.74)
где q – естественные координаты, которые составляют матрицу столбец 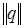 , q s – координаты симметрии, С – матрица линейного преобразования от координат симметрии к естественным координатам. Для трехатомной молекулы воды имеем:
, q s – координаты симметрии, С – матрица линейного преобразования от координат симметрии к естественным координатам. Для трехатомной молекулы воды имеем:
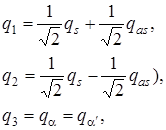 (10.75)
(10.75)
где a - угловая координата. Матрица преобразования запишется в виде
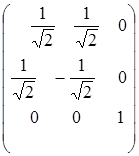 . (4.76)
. (4.76)
Все естественные координаты можно разбить на совокупности эквивалентных координат данного рода. Одна какая-нибудь совокупность эквивалентных координат должна быть выражена только через ограниченное число координат симметрии, относящихся ко всем этим совокупностям. Поэтому в матрице С появляются нули. Число координат симметрии равно п – числу колебательных степеней свободы.
Расчет коэффициентов матрицы С представляет собой трудную задачу, однако она уже решена для различных точечных групп. Матрица С определяется группой симметрии, к которой принадлежит молекула. Переход к координатам симметрии позволяет упростить решение задачи о колебаниях, т. е. понизить порядок векового уравнения.
 2015-09-06
2015-09-06 640
640








