Цель работы: определить методом Клемана-Дезорма отношение теплоемкостей газа.
Оборудование: закрытый стеклянный баллон; U - образный манометр; поршневой насос.
Краткие теоретические сведения .
Теплоемкостью вещества называют количество тепла, которое необходимо сообщить телу, чтобы повысить его температуру на один кельвин.
Теплоемкость единицы массы вещества называют удельной теплоемкостью (Суд), а теплоемкость одного моля вещества - молярной теплоемкостью (С m).
Таким образом,
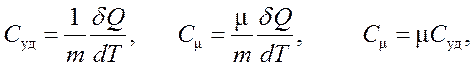
где С уд и С m - удельная и молярная теплоемкости,
dQ - количество сообщенного тепла,
dT - изменение температуры тела при нагревании,
m и m - масса вещества и масса моля этого вещества соответственно.
Величина теплоемкости газа сильно зависит от условий нагревания.
При изобарическом нагревании (P=const) подведенное к газу тепло расходуется на увеличение его внутренней энергии и на совершение работы:
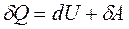 . (1)
. (1)
Изменение внутренней энергии идеального газа вычисляется по формуле:
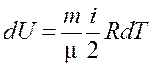 ,
,
где i - число степеней свободы молекул газа,
R - универсальная газовая постоянная (8,315 Дж/моль×К).
Элементарная работа газа при равновесном расширении:

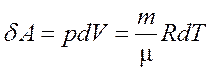 . (2)
. (2)
Таким образом,
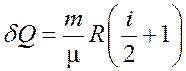 .
.
Из формул (1) и (2) получается выражение для молярной теплоемкости идеального газа при постоянном давлении:
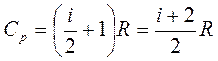 . (3)
. (3)
При изохорическом нагревании газа (V =const) его работа равна нулю (dA = pdV = 0), все подведенное тепло идет на приращение внутренней энергии газа (dQ = dU) и молярная теплоемкость
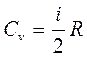 . (4)
. (4)
Таким образом, теплоемкость идеального газа не зависит от температуры, a oпределяется только числом степеней свободы молекул газа и характером изменения состояния.
Из выражения (3) и (4) следует, что отношение теплоемкости Сp к теплоемкости СV:
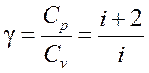 . (5)
. (5)
Величину g называют коэффициентом Пуассона, или показателем адиабаты.
Определение g важно потому, что эта величина входит в уравнения, описывающие адиабатические процессы, для которых dQ=0, и процессы, близкие к ним, такие, как распространение звука, течение газов со звуковыми и сверхзвуковыми скоростями и т. п.
Конечно, для однородного газа g легко рассчитать по формуле (5). Однако, для смеси газов расчет осложняется, так как нужно знать процентное содержание каждого газа в смеси. В этом случае удобнее g определять опытным путем.
В настоящей работе для определения g воздуха предлагается метод Клемана и Дезорма.
 2015-09-06
2015-09-06 2311
2311
