Как видно из приведенных уравнений, при тепловом расчете реактора необходимо обязательно знать энтальпии реакций, энтальпии фазовых переходов компонентов и теплоемкости компонентов.
Если отсутствует табличное значение, то энтальпию реакции можно опре-
делить по стандартным энтальпиям образования или сгорания компонентов в со
ответствии с законом Гесса. Для реакции
аА + bВ = rR + sS + ∆Нr,
стандартная энтальпия реакции, рассчитанная по энтальпиям образования, равна
∆H°r = r H°R + s H°S - аН°А - b H°B.
Соответственно по энтальпиям сгорания
∆H°r = а Н°А + b Н°В - r H°R - s H°S
Значения стандартных энтальпий образования и сгорания можно найти в справочниках физико-химических величин. Значение энтальпии реакции при температуре реакции определяется уравнением
∆HTr = ∆H°r + (аСРА + bСРВ - rСРR - sСPS)(Т - Т0),
где СРi - мольная теплоемкость i-того компонента; Т0 - «стандартная» температура; Т - расчетная температура.
Энтальпии компонентов можно рассчитать, используя энтальпии фазовых пере
ходов и температурные зависимости теплоемкостей фаз. При условии задания уровня отсчета Тс общая формула при этом будет иметь вид
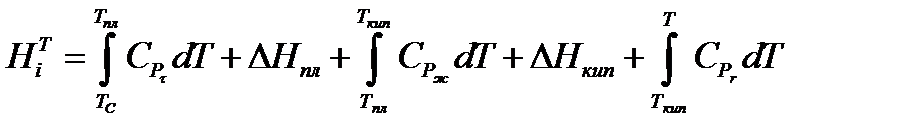
Индекс «пл» относится к температуре и энтальпии плавления, «кип» - к температуре и энтальпии кипения; «т», «ж» и «г» - соответственно к твердому телу, жидкости и газу. Температурные зависимости теплоемкостей для многих веществ можно найти в справочниках физико-химических величин, где они выражаются формулами:
СР = а + bТ + сТ2 +...,
СР =а + bТ + с'Т-2.
Если в данном температурном интервале в указанных уравнениях не окажется коэффициентов, то можно взять среднее значение теплоемкости, полученное из таблиц, или же рассчитанное по эмпирическим зависимостям.
Эмпирические зависимости расчета теплоемкости зависят от фазового состояния вещества. Так мольную теплоемкость металлов и других кристаллических веществ можно ориентировочно рассчитать по правилу Дюлонга и Пти, которое предполагает, что каждый атом соединения вносит в молекулу долю теплоемкости, равную примерно 26 Дж/(моль∙К). Поэтому расчет удельной теплоемкости соединения можно провести по формуле
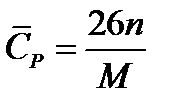
где n - число атомов в молекуле; М - молекулярная масса соединения, кг/моль.
Теплоемкость многих твердых веществ - величина аддитивная и примерно равна сумме атомных теплоемкостей (правило Коппа):
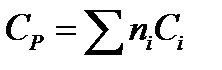 ,
,
где ni - число атомов данного вида; Сi - атомная теплоемкость, выбираемая из табл. 9.7.
Таблица 9.7. Атомные составляющие теплоемкости твердых веществ
| Атом | Составляющая, Дж/(моль∙К) | Атом | Составляющая, Дж/(моль∙К) |
| С | 7,53 | F | 20,92 |
| H | 9,62 | Р | 23,0 |
| O | 16,74 | Ве | 15,9 |
| S | 22,59 | N | 11,3 |
| В | 11,72 | Другие | |
| Si | 20,08 | атомы | 25,92 - 26,78 |
Вопрос о расчете теплоемкости некристаллических твердых соединений пока еще не решен, хотя с достаточно высокой ошибкой ее можно определить по правилу Коппа.
Мольная теплоемкость идеальных газов при обычной температуре и давлении выражается соотношениями, приведенными в табл. 9.8.
Таблица 9.8. Мольные теплоемкости идеальных газов
| Вид газа | СV | CР | Вид газа | СV | CР |
| одноатомный двухатомйый | 1,5R 2,5R | 2,5R 3,5R | многоатомный | 3R | 4R |
Здесь СV и СP - теплоемкости при постоянном объеме и постоянном давлении, соответственно, а R - универсальная газовая постоянная; R= 8,314 Дж/(моль∙К).
Ориентировочное значение удельной теплоемкости в Дж/(кг∙К) можно получить из следующих формул:
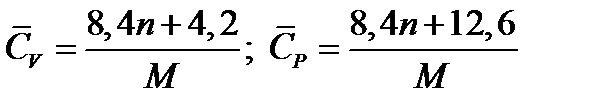
где n - число атомов в молекуле газа или пара; М - его молекулярная масса, кг/моль.
Зависимость теплоемкости газов и парогазовых смесей от давления и температуры ориентировочно определяется по формуле
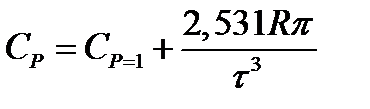
где СР - теплоемкость при атмосферном давлении, Дж/(моль∙К);
π - приведенное избыточное давление газа, π = Р/Ркр; Р - избыточное давление газа, Па; Ркр - критическое давление газа, Па; τ - приведенная температура газа,
τ = Т/Ткр; Т - температура газа, К; Ткр - критическая температура газа.
Теплоемкость газовых и парогазовых смесей можно приближенно определить из выражения
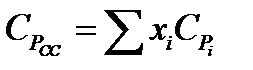
где хі - мольная или объемная доля компонента в смеси.
Пример 9.7. Определить теплоемкость азота при температуре 50 °С и абсолют-
ном давлении 20 МПа.
Решение: По литературным данным для азота критическая температура равна 125,9 К, критическое давление - 3,285 МПа, молекулярная масса - 0,028 кг/моль. Определим изобарную теплоемкость при обычной температуре и атмосферном давлении
СР=1 = 3,5∙8,314 = 29,1 Дж/(моль К).
Приведенная температура
τ = Т/Ткр = (273+50)/125,9 = 2,566
Приведенное избыточное давление
π = Р/Ркр = (20-1)/3,285
Тогда
СР = 29,1 + (2,531∙8,314∙5,783)/2,566 = 36,6
Или по удельной теплоемкости
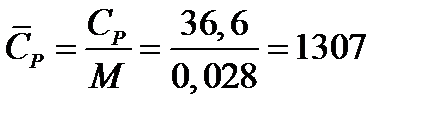
Удельная теплоемкость подавляющего большинства жидкостей лежит в пределах 1600 - 2400 Дж/(моль∙К), для большинства углеводородов этот параметр примерно равен 2100 Дж/(моль∙К).
Ориентировочную оценку мольной теплоемкости жидкостей можно провести, используя правило Коппа, которое применимо для температуры 20 °С:
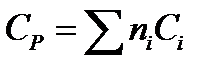
где ni - число атомов данного вида; Сi - атомная теплоемкость, выбираемая из табл. 9.9.
Мольную теплоемкость жидкостей при 20 °С можно вычислить по методу Джонсона - Хуанга: 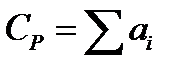 ,
,
где аi - атомная или групповая составляющие (см. табл. 9.10).
Таблица 9.9. Атомные составляющие теплоемкости жидкостей
| Атом | Составляющая, Дж/(моль∙К) | Атом | Составляющая, Дж/(моль∙К) |
| С | 11,72 | Si | 24,27 |
| H | 17,99 | F | 29,29 |
| О | 25,10 | Р | 29,29 |
| S | 30,96 | Другие | |
| В | 19,66 | атомы | 33,5 |
Таблица 9.10. Атомные и групповые составляющие
метода Джонсона - Хуан га
| Атом, | ai | Атом, | ai |
| группа | Дж/(моль К) | группа | Дж/(моль К) |
| Н (в муравьиной | ---C | 58,19 | |
| кислоте и ее эфирах) | 14,86 | ---CH= | 46,05 |
| ---CH3 | 41,44 | ---NH2 | 63,63 |
| ---CH2--- | 26,37 | ---С1 | 36,00 |
| ==CH--- | 22,60 | ---Вг | 15,49 |
| ---COOH | 79,95 | ---NO2 | 64,05 |
| ---COO--- | ---О--- (простые эфиры) | 35,16 | |
| (сложные эфиры) | 60,70 | ---S--- | 44,37 |
| >C=O | 61,53 | ---С6Н5 | 127,67 |
Пример 9.8 Вычислить по методу Джонсона - Хуанга теплоемкость бензола (С6Н6) при 20 °С.
Решение: Бензол можно представить состоящим из шести групп =СН—, тогда Ср=6∙22,6 = 135,6 Дж/(моль∙К).
Опытное табличное значение 136,2 Дж/(моль∙К).
Вторая формула Джонсона - Хуанга дает возможность получить температурную зависимость теплоемкости
СР = а + bТ + сТ2 + dТ3
Коэффициенты а, b, с и d представлены в табл. 9.11.
Важной характеристикой при тепловом расчете реакторов может являться энтальпия испарения. В том случае, если нельзя найти ее табличное значение, ее можно рассчитать. Наиболее простым, но и не вполне точным методом является правило Трутона:
Lисп.к = 87,9 Тк,
где Lисп.к - энтальпия испарения при температуре кипения, Дж/моль; Тк - температура кипения, К.
Более точным является метод Джиаколоне:
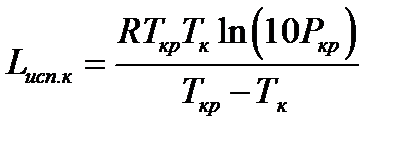
где Ткр и Ркр - критические температура (К) и давление (МПа).
Таблица 9.11. Расчет теплоемкости по методу Джонсона—Хуанга
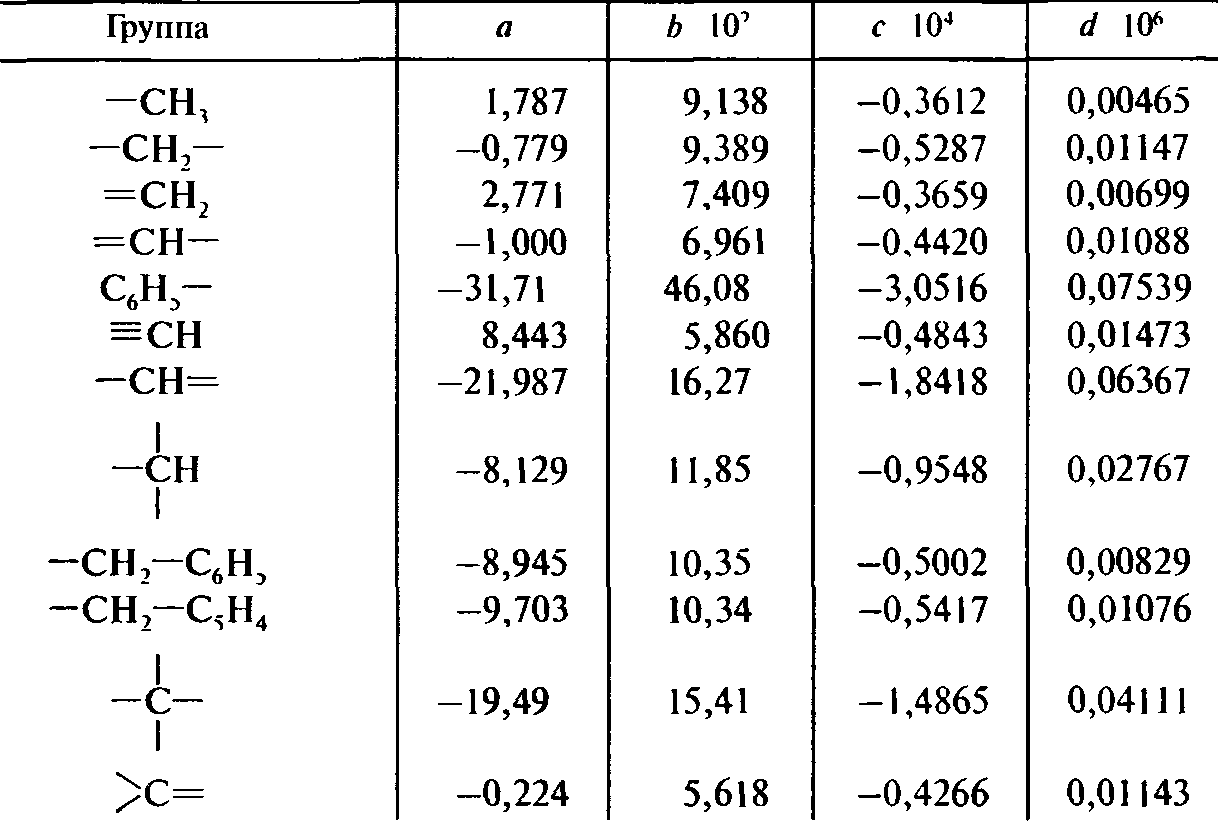
Энтальпию плавления можно приближенно определить по формуле
Lпл = 56,5Тпл
где Lпл - энтальпия плавления, Дж/моль; Тпл - температура плавления, К.
Для органических соединений соотношение между энтальпиями испарения и плавления имеет вид
Lпл ≈ 0,356 Lисп.к.
 2015-04-30
2015-04-30 11089
11089
