В тепловых двигателях (машинах) рабочим телом являются смеси различных газов. Если компоненты смеси не вступают в химические реакции между собой, и каждый компонент подчиняется уравнению состояния Клайперона, то такая смесь рассматривается как идеальный газ.
Для расчета смеси необходимо определить μсм- среднемолярную массу и Rcм-удельную газовую постоянную смеси. Для их определения необходимо знать состав смеси, т. е. какие компоненты и в каких количествах образуют данную смесь, какие параметры имеет каждый компонент входящий в смесь.
Каждый компонент смеси ведет себя так, как если бы в смеси не было других газов, занимает весь располагаемый объем, в котором находится смесь, следует своему уравнению состояния и оказывает на стенки свое так называемое парциальное давление, при этом температура всех компонентов смеси одинакова и равна температуре смеси.
По закону Дальтона давление смеси Р равно сумме парциальных давлений отдельных компонентов, входящих в смесь:
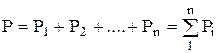 , (1.20)
, (1.20)
где n- число компонентов смеси.
По закону Амага - объем смеси V равен сумме парциальных объемов отдельных компонентов, входящих в смесь при температуре и под давлением смеси:
 , (1.21)
, (1.21)
где  - парциальный объем, м3; V- объем смеси, м3
- парциальный объем, м3; V- объем смеси, м3
Состав смеси задают объемными (молярными) или массовыми долями.
Объемная доля i-го компонента  - это отношение парциального объема компонента к объему смеси, т. е.
- это отношение парциального объема компонента к объему смеси, т. е. 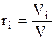 , тогда сумма объемных долей компонентов смеси равна 1, т. е.
, тогда сумма объемных долей компонентов смеси равна 1, т. е.  . Если значение
. Если значение  заданы в %, то их сумма = 100%.
заданы в %, то их сумма = 100%.
Молярная доля i-го компонента ni – это отношение числа киломолей компонента Ni к числу киломолей смеси N, т. е.  , где
, где  ,
,  , т. е. число киломолей каждого компонента и смеси в целом равно отношению соответствующего на объем, занимаемый одним киломолем компонента
, т. е. число киломолей каждого компонента и смеси в целом равно отношению соответствующего на объем, занимаемый одним киломолем компонента  и смеси в целом
и смеси в целом  .
.
Учитывая, что идеальный газ при одинаковых условиях имеет одинаковый объем киломоля, то после подстановки получаем:  , т. е. для идеальных газов молярные и объемные доли численно равны.
, т. е. для идеальных газов молярные и объемные доли численно равны.
Массовая доля i-го компонента  - это отношение массы компонента
- это отношение массы компонента  к массе смеси
к массе смеси  :
:  , отсюда следует, что масса смеси равна сумме масс компонентов
, отсюда следует, что масса смеси равна сумме масс компонентов  , а так же сумма массовых долей компонентов равна 1 (или 100%).
, а так же сумма массовых долей компонентов равна 1 (или 100%).
Пересчет объемных долей в массовые и обратно производится на основе следующих соотношений:
 ,
,
где ρ = μ/22,4, кг/м3.
Откуда следует, что массовая доля i-го компонента определится из соотношения:
 ,
,
где  - плотность смеси, кг/м3,
- плотность смеси, кг/м3, 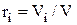 - объемная доля i-го компонента.
- объемная доля i-го компонента.
В дальнейшем можно определить через объемные доли.
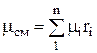 ,
,
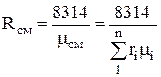 .
.
Плотность смеси для объемных долей определяется из соотношения
 , откуда
, откуда 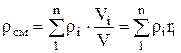 , (1.22)
, (1.22)
а также
 .
.
Парциальное давление определяется по формулам:
 или
или  (1.23)
(1.23)
Уравнения состояния компонентов и смеси в целом имеют вид:
 ;
;
 ,
,
откуда после преобразований получаем для массовых долей
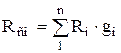 ,
,  . (1.24)
. (1.24)
Плотность и удельный объем смеси для массовых долей:
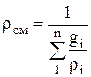 ;
;  . (1.25)
. (1.25)
Для расчета парциальных давлений используется формула:
 . (1.26)
. (1.26)
Пересчет массовых долей в объемные выполняется по формуле:
 .
.
При определении теплоемкости смеси газов исходят из положения о том, что для нагрева (охлаждения) газовой смеси необходимо нагреть (охладить) каждый из компонентов смеси
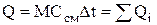 , (1.27)
, (1.27)
где Qi=Mici∆t – теплота, затраченная на изменение температуры i-го компонента смеси, сi – массовая теплоемкость i-го компонента смеси.
Теплоемкость смеси определяется из соотношения (если смесь задана массовыми долями)
 , аналогично
, аналогично  . (1.28)
. (1.28)
Молярная и объемная теплоемкости для смеси заданной объемными долями определяются
 ;
;  ;
;
(1.29)
 ;
; 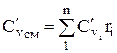
Пример 1.5 Сухой воздух по массе состоит из gО2=23,3% кислорода и gN2=76,6% азота. Определить состав воздуха по объему (rО2 и rN2) и газовую постоянную смеси.
Решение.
1. Из табл.1 находим  кг/кмоль и
кг/кмоль и  кг/кмоль
кг/кмоль
2. Определяем объемные доли кислорода и азота:


1. Газовая постоянная воздуха (смеси) определится по формуле:
 , Дж/кг·К
, Дж/кг·К
Пример 1.6. Определить количество теплоты потребное для нагревания газовой смеси массой М=2 кг при Р=const, состоящей в % по массе:  ,
,  ,
, 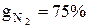 ,
, 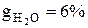 , при изменении температуры от t1=900 оС до t2=1200 оС.
, при изменении температуры от t1=900 оС до t2=1200 оС.
Решение:
1. Определяем среднюю массовую теплоемкость компонентов, составляющих газовую смесь при Р=const и t1=900 оС (из П2):
 =1,0258 кДж/кг·К;
=1,0258 кДж/кг·К;  =1,1045 кДж/кг·К;
=1,1045 кДж/кг·К;
 =1,1078 кДж/кг·К;
=1,1078 кДж/кг·К;  =2,1097 кДж/кг·К;
=2,1097 кДж/кг·К;
2. Определяем среднюю массовую теплоемкость компонентов, составляющих газовую смесь при Р=const и t1=1200 оС (из П2):
 =1,0509 кДж/кг·К;
=1,0509 кДж/кг·К;  =1,153 кДж/кг·К;
=1,153 кДж/кг·К;
 =1,1359 кДж/кг·К;
=1,1359 кДж/кг·К;  =2,2106 кДж/кг·К;
=2,2106 кДж/кг·К;
3. Определяем среднюю массовую теплоемкость смеси для интервала температур: t2 =1200 оС и t1 =900 оС:
 кДж/кг·К
кДж/кг·К
 кДж/кг·К
кДж/кг·К
4. Количество теплоты для нагревания 2 кг смеси при Р=const:

 кДж
кДж
Первый закон термодинамики устанавливает количественную связь между изменением внутренней энергии системы и механической работой, совершаемой против сил внешнего давления окружающей среды в результате подвода теплоты к рабочему телу.
Для закрытой термодинамической системы уравнение первого закона имеет вид
 (1.30)
(1.30)
Теплота, сообщаемая рабочему телу (или системе) идет на приращение ее внутренней энергии (dU), вследствие повышения температуры тела, и на совершение внешней работы (dL), вследствие расширения рабочего тела и увеличения его объема.
Первый закон может быть записан в виде dH=dq+VdP=dq-dL0,
где dL0=VdP – элементарная работа изменения давления называется полезной внешней (технической) работой.
dU – изменение внутренней энергии рабочего тела (системы), включающей в себя энергию теплового движения молекул (поступательное, вращательное и колебательное) и потенциальную энергию взаимодействия молекул.
Так как переход системы из одного состояния в другое происходит в результате подвода теплоты, поэтому рабочее тело нагревается и его температура повышается на dT и объем увеличивается на dV.
Повышение температуры тела вызывает увеличение кинетической энергии его частиц, а увеличение объема тела приводит к изменению потенциальной энергии частиц. В результате внутренняя энергия тела увеличивается на dU, поэтому внутренняя энергия U есть функция состояния тела и может быть представлена в виде функции двух независимых параметров U=f1(P,V); U=f2(P,T), U=f3(υ,T). Изменение внутренней энергии в термодинамическом процессе определяется только начальным (U1) и конечным (U2) состоянием т. е.
 (1.31)
(1.31)
В дифференциальном виде изменение внутренней энергии запишется
а) в функции от удельного объема и температуры

б) в функции от температуры, т.к.  , то
, то 
Для практических расчетов, в которых необходимо учесть изменение Сv от температуры, имеются эмпирические формулы и таблицы удельной внутренней энергии (часто молярной). Для идеальных газов молярная внутренняя энергия смеси Uм определяется по формуле
 , Дж/кмоль
, Дж/кмоль
Для смеси заданной массовыми долями  . Таким образом внутренняя энергия есть свойство системыи характеризует состояние системы.
. Таким образом внутренняя энергия есть свойство системыи характеризует состояние системы.
Энтальпия – тепловая функция состояния, введенная Камерлинг-Оннесом, (лауреат Нобелевской премии, 1913 г.), представляющая собой сумму внутренней энергии, системы U и произведение давления системы P на ее объем V.

Так как входящие в нее величины являются функциями состояния, поэтому H также функция состояния т. е. Н=f1(P,V); H=f2(V,T); H=f3(P,T).
Изменение энтальпии dH влюбом термодинамическом процессе определяется начальным H1 и конечном H2 состоянием и не зависит от характера процесса. Если система содержит 1 кг вещества, то применяется удельная энтальпия  , Дж/кг.
, Дж/кг.
Для идеального газа дифференциальное уравнение имеет вид
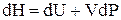
соответственно удельная энтальпия определяется по формуле
 (1.32)
(1.32)
Уравнение первого закона термодинамики dq=dU+Pdυ, когда единственным видом работы является работа расширения Pdυ=d(Pυ)- υdP, тогда dq=d(U+Pυ)-υdP, откуда
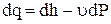
Для изобарного процесса (dP=0), тогда

В практических расчетах это выражение очень часто используется, поэтому имеется множество таблиц, в которых приводятся значения энтальпии.
Соотношение между dh и dU составляют  , т. е. изменение энтальпии в термодинамическом процессе в «к» раз больше изменения внутренней энергии.
, т. е. изменение энтальпии в термодинамическом процессе в «к» раз больше изменения внутренней энергии.
Для расчетов смеси идеального газа применяют соотношения, соответственно для полярной и массовой энтальпии,
 ;
; 
Энтропия – есть мера необратимого рассеяния энергии, введена P. Клаузиусом (1865 г.)
Для термодинамической системы, совершающей бесконечно медленно (квазистатически) цикличный процесс, в котором системы последовательно получает малые количества теплоты dQ при соответствующих значениях температуры Т, интеграл от приведенного количества теплоты  по всему циклу равен 0 (т. е.
по всему циклу равен 0 (т. е.  , равенства Клаузиуса) Дифференциал этой функции состояния называется энтропией. Для произвольного количества газа энтропия определяется
, равенства Клаузиуса) Дифференциал этой функции состояния называется энтропией. Для произвольного количества газа энтропия определяется  , для 1 кг вещества
, для 1 кг вещества  , Дж/(кг·К). Дифференцмал для элементарного обратимого процесса одного кг газа составит
, Дж/(кг·К). Дифференцмал для элементарного обратимого процесса одного кг газа составит 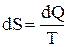 , если dQ=СdT, тогда
, если dQ=СdT, тогда

и при  ,
, 
Энтропия может быть представлена в виде функции любых двух параметров состояния 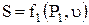 ;
;  ;
; 
При температурах, близких к абсолютному нулю энтропия вещества, находящегося в конденсированном состоянии с упорядоченной кристаллической структурой, стремится к нулю (т. е. S0 = 0 при Т = 0, К).
В технической термодинамике изменение энтропии ∆S в процессе определится по формуле
 , (1.33)
, (1.33)
Поэтому энтропию отсчитывают от произвольно выбранного уровня только ее «приращение».
Для идеального газа при Сv=const

или после подстановки
 ;
; 
получим
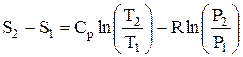
(1.34)

Поскольку энтропия есть функция состояния рабочего тела, то приведенные уравнения не зависят от пути перехода рабочего тела между состояниями 1 и 2, а также равновесный этот переход или нет.
В расчетах используют T-S диаграмму, на которой состояние системы изображается «точкой», а термодинамический процесс линией.
На диаграмме T-S – элементарная теплота процесса δq изображается элементарной площадкой высотой Т и основанием dS, а площадь под линией процесса эквивалентна теплоте процесса.
Если δq > 0, то теплота подводится и энтропия рабочего тела возрастает (dS > 0), если δq < 0, то теплота отводится и энтропия тела убывает (dS < 0)
Рис.
 2014-02-24
2014-02-24 6515
6515
