Изложенные выше соображения о возможном числе степеней свободы молекул в некоторых случаях позволяют истолковать экспериментальные данные о теплоемкости многоатомных газов. Так, например, из того факта, что теплоемкость водорода, азота, кислорода и некоторых других двухатомных газов довольно точно равна 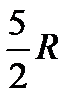 , следует, что число степеней свободы молекул этих газов равно 5. Это значит, что молекулы этих газов можно считать жесткими (колебательные степени свободы не возбуждены). То же относится и к некоторым трехатомным газам. Но здесь экспериментальные результаты обнаруживают существенные отклонения от теоретически ожидаемых. Из формулы (93) следует, что теплоемкость CV для «жестких» трехатомных молекул должна равняться
, следует, что число степеней свободы молекул этих газов равно 5. Это значит, что молекулы этих газов можно считать жесткими (колебательные степени свободы не возбуждены). То же относится и к некоторым трехатомным газам. Но здесь экспериментальные результаты обнаруживают существенные отклонения от теоретически ожидаемых. Из формулы (93) следует, что теплоемкость CV для «жестких» трехатомных молекул должна равняться 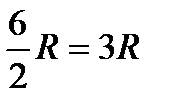 . Между тем теплоемкости трехатомных газов оказываются несколько больше этого значения (на величину, которую нельзя объяснить погрешностями измерения).
. Между тем теплоемкости трехатомных газов оказываются несколько больше этого значения (на величину, которую нельзя объяснить погрешностями измерения).
На трудности наталкивается и попытка объяснить с точки зрения изложенной теории найденные значения теплоемкости хлора. Экспериментально измеренное значение теплоемкости хлора СV = 3,02R соответствует шести степеням свободы для молекулы хлора. Но молекула хлора, как двухатомная, может иметь либо пять степеней свободы, если два его атома жестко связаны между собой (тогда  СV = 2,5 R), либо семь степеней свободы,если атомы внутри молекулы могут совершать колебания (тогда СV = 3,5).
СV = 2,5 R), либо семь степеней свободы,если атомы внутри молекулы могут совершать колебания (тогда СV = 3,5).
Как видно, и в этом случае теория теплоемкости не может считаться удовлетворительной. Это объясняется тем, что эта теория не в состоянии должным образом учесть энергию, связанную с внутренними движениями в молекуле, к которым закон равнораспределения не всегда применим.
Особенно важным отклонением от результатов теории является тот факт, что теплоемкость оказывается зависящей от температуры, в то время как, согласно уравнению (93), она должна быть для данного газа с данным значением i величиной постоянной. Опыт показывает, что теплоемкость с понижением температуры уменьшается.
Эту зависимость можно было бы объяснить тем, что с изменением температуры изменяется число «действующих» степеней свободы молекул, т. е. какие-то движения молекул, происходящие в одной области температур, прекращаются в другой. Однако такое предположение требует, чтобы теплоемкость изменялась с температурой скачками. Ведь то или иное движение может или происходить, или не происходить; в первом случае ему соответствует энергия kT/2, во втором эта энергия и связанный с ней вклад в теплоемкость отсутствуют. Возможно, конечно, не внезапное прекращение или возникновение того или иного вида движения молекулы, а постепенное изменение его интенсивности. Но закон равнораспределения не различает этого; с любой степенью свободы связана одна и та же энергия. Между тем температурная зависимость теплоемкости, как показывает опыт, имеет плавный ход — теплоемкость изменяется постепенно. Это свидетельствует о том, что закон равномерного распределения энергии по степеням свободы не может считаться вполне верным и имеет ограниченную применимость.
Тема 7. Термодинамическое описание процессов в идеальных газах
 2015-02-15
2015-02-15 3690
3690
