Мікроорганізми, які населяють ґрунт, воду, оточуючі нас предмети і субстрати, організми рослин, тварин і людини, живуть і розмножуються у складі мікробіоценозів. Для ідентифікації виду мікроорганізму необхідно ізолювати його із суміші організмів, виділити в чисту культуру, а потім вивчити його морфологічні та біохімічні властивості.
Вирощування мікроорганізмів на живильних середовищах називається культивуванням, а розвинені мікроорганізми, отримані від тварини, людини, чи рослини,субстрату зовнішнього середовища, – культурою. Розвиток культури мікроорганізмів в рідкому середовищі приводить до утворення суспензії або осаду, плівки, на твердому середовищі – колонії. Культивування за умов визначеної температури (у термостаті) називається інкубацією.
У мікробіологічній практиці широко використовуються як чисті культури мікроорганізмів, так і консорціуми.
Для вивчення фізіолого-біологічних особливостей розвитку бактерій, а також для встановлення їхньої видової приналежності необхідно виділяти чисті культури, що складаються з мікроорганізмів одного виду.
Консорціуми – змішані чи асоціативні культури, що складаються з 2-х і більш мікроорганізмів, між якими існують різні форми взаємин.
Чиста культура мікроорганізмів одного виду, що виділена з визначеного джерела і відрізняється від інших представників виду незначними змінами, називається штамом. Чиста культура мікроорганізмів, що є потомством однієї єдиної клітини, називається клоном.
Виділення чистої культури проводять поетапно:
· одержання накопичувальної культури;
· виділення чистої культури з ізольованих колоній за методом Коха;
· визначення чистоти культури, що виділена, та вивчення культуральних властивостей;
· ідентифікація мікроорганізмів із різних властивостей: морфологічних, тинкторіальних, біохімічних (ферментативних), антигенних і т.п.
Накопичувальними культурами називаютьсякультури, які складаються переважно з кліток одного виду.
Для одержання мікроорганізмів визначених фізіологічних груп Виноградським запропонована техніка “накопичувальних культур”, заснована на використанні елективних (виборчих) середовищ, що забезпечують переважний розвиток визначених бактерій. Інші організми в цих умовах не можуть розмножуватися чи їхній ріст буде дуже незначний.
Внесення кліток мікроорганізмів (зразка ґрунту, проби води) у стерильне живильне середовище для одержання накопичувальної чи чистої культури називається посівом, чи інокуляцією. Для одержання накопичувальних культур кращим матеріалом для інокуляції служать субстрати, у яких відбувається їх природне “збагачення”.
Елективні умови передбачають ряд факторів, наприклад, потреба мікроорганізмів у живильному субстраті, відношення до кисню, кислотності середовища, температурі, здібність до спороутворення і т.д.
Підбираючи оптимальний склад живильного середовища та параметри культивування й інокулюючи середовище якими-небудь природними субстратами, що містять різноманітні мікроорганізми, можна одержати накопичувальну культуру організмів, що характеризуються визначеними фізіолого-біохімічними властивостями. З накопичувальних культур виділяють чисту культуру мікроорганізмів.
Після того, як одержана накопичувальна культура, приступають до виділення чистої. Чиста культура може бути одержана з окремої колонії або з одної клітини. Основним методом виділення чистих культур є метод Коха. Принцип його полягає в одержанні чистої культури з ізольованої колонії, що розвилася з однієї клітини.
Виділення чистої культури проводять з отриманої накопичувальної культури. Чиста культура може бути одержана механічним роз'єднанням мікроорганізмів методами, що використовують їхні біологічні особливості.
Метод заснований на тому, що за умов нанесення мікроорганізмів з посівного матеріалу на густе середовище окремі клітини будуть закріплюватися (імобілізуватися) у визначеній крапці твердого середовища і, розмножуючись, давати потомство (клон), що представляє колонію чистої культури мікроорганізмів.
Спочатку вирощують культуру з механічним відокремлюванням клітин мікроорганізмів за посівом на густі живильні середовища в чашки Петрі. Таким чином одержують ізольовані колонії, припускаючи, що вони виросли з однієї клітини, і паралельно вивчають культуральні властивості.
Потім проводять виділення чистої культури з ізольованих колоній на скошений агар. Після цього ідентифікують мікроорганізми з різноманітних властивостей.
До культуральних, чи макроморфологічних, властивостей відносяться характерні риси росту мікроорганізмів на твердому й рідкому живильному середовищах. На поверхні твердих живильних середовищ мікроорганізми можуть рости у вигляді характерних колоній, чи штрихів суцільного газону. Колонією називають ізольоване скупчення кліток одного виду, що виросло в більшості випадків з однієї клітини. У залежності від того, де росте мікроорганізм (на поверхні густого живильного середовища, в товщі її чи на дні судини), розрізняють поверхневі, глибинні і донні колонії. Колонії, що виросли на поверхні середовища, відрізняються великою різноманітністю і є найбільш істотною особливістю росту багатьох мікроорганізмів на твердому субстраті. В описі колоній враховують наступні ознаки: форму, профіль, край, структуру, розмір, поверхню, колір колонії. Культуральні властивості є діагностичними для ідентифікації мікроорганізмів.
Чистота культури мікроорганізмів повинна бути ретельно перевірена. Це здійснюється, як правило, декількома способами – візуальним (дослідження колоній), мікроскопічним контролем і висівом на ряд живильних. середовищ
Звичайно колонії з кліток чистої культури, що висіяна на густе середовище, схожі одна на іншу, що є доказом чистоти культури (але є виключення, наприклад, у випадку дисоціації колоній на гладкі (S-) і складчасті (R - форми).
Інший критерій чистоти культури – це морфологія кліток. Для чистої культури характерний високий ступінь морфологічної подібності кліток у забарвлених препаратах. Однак бувають виключення у залежності від віку культури, використовуваного середовища й інших умов росту.
Порядок виконання роботи
1. Для вивчення мікрофлори повітря зробити посів із повітря на МПА й СА живильне середовище у чашки Петрі.
Мікробіологічний метод дослідження повітря, що заснований на седиментації, зв'язаний з осіданням бактеріальних клітин під впливом сили ваги на поверхню агару відкритої чашки Петрі. Метод дає представлення в основному про якісний зміст мікроорганізмів. Загальну кількість бактерій, що зустрічаються в повітрі, враховують за ростом колоній мезофільних мікроорганізмів на МПА, проби відбирають на рівні подиху сидячої людини.
Чашки з МПА експонують 5–10–15 хвилин у залежності від передбачуваного бактеріального забруднення. Орієнтовно відповідно до перерахунку за Омелянським на поверхню 100 см2 агару осідає за 5 хвилин така кількість бактерій, що міститься в 10 л повітря.
Результати роботи протоколюють. Результати всіх посівів розглянути на наступному занятті.
2. Виконати посів за методом Коха суспензії зі зразка ґрунту, що розведений в 1000, 10000 раз на тверде вівсяне живильне середовище, МПА і середовище Гаузе.
· Наважку підготовленого ґрунту (1 г) поміщають у чисту ступку з невеликою кількістю стерильної води і розтирають гумовою маточкою чи пальцем у гумовій рукавичці приблизно 5 хв.
· Підготовлену суспензію переносять у колбу з 100 мл стерильної водопровідної води. Готують розведення ґрунтової суспензії, для чого 1 мл суспензії переносять послідовно в ряд пробірок з 9 мл стерильної водопровідної води.
· На поверхню твердого й підсушеного середовища наносять краплю ґрунтової суспензії визначеного розведення й за допомогою стерильного скляного шпателя розподіляють по всьому агару. Якщо висів проводять, починаючи з великих розведень, то використовують нову стерильну піпетку і новий шпатель для кожного розведення.
· Засіяні чашки Петрі перевертають нагору дном і поміщають у термостат із визначеною температурою, яка сприятлива для розвитку мікроорганізмів, що враховуються.
· Підрахунок колоній, що виросли, проводять через визначений час після посіву (3–5 доби). На МПА звичайно на 2–3 добу інкубації враховують спорові й безспорові форми бактерій. На середовищі Гаузе на 5–7 добу враховують колонії актиноміцетів, на сусло-агарі на 5–7 добу – колонії грибів і дріжджів.
· Колонії, як правило, рахують, не відкриваючи чашки Петрі, у прохідному світлі. Для зручності дно чашки поділяють на сектори, підраховують кількість колоній у кожнім секторі, кожну відлічену колонію позначають крапкою (маркером) із нижньої сторони чашки Петрі й результати підсумовують. Для підрахунку колоній зручно користатися спеціальним приладом із лічильником.
· Точність методу залежить від числа підрахованих колоній: кращим розведенням вважають те, у висіві якого на твердому живильному середовищі виростає від 50 до 150 колоній.
· Підрахувавши кількість колоній на всіх паралельних чашках, обчислюють їхнє середнє число на одній чашці і потім роблять перерахування для визначення вмісту мікроорганізмів в 1 г ґрунту за формулою:
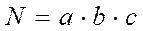
де N – кількість кліток у 1 г ґрунту; a – середня кількість колоній на чашці, b – розведення, із якого зроблений посів; c – кількість крапель у 1 мл суспензії.
Результати роботи протоколюють.
Петлі, голки обпалюють у полум'ї пальника. Посуд дезінфікують.
3. Дослідити мікрофлору водопровідної води.
· Протягом 10–15 хвилин воду спускають з водопровідної труби, після чого полум’ям спиртівки обпалюють кран. Воду набирають в стерильну колбу. До цього готують дві пробірки зі стерильною водою, три стерильні чашки Петрі і три піпетки.
· Із колби, в яку відібрана вода для дослідження, піпеткою відбирають 2 мл; 1 мл вносять в першу стерильну чашку і 1 мл – в першу пробірку з 9 мл стерильної води. Другою піпеткою воду перемішують в першій пробірці. Отримують розведення 1:10. Потім цією ж піпеткою 1 мл розведення переносять у другу стерильну чашку і 1 мл – у другу пробірку з 9 мл стерильної води, але не перемішують. Третьою піпеткою перемішують воду у другій пробірці (розведення 10-2) і 1 мл переносять у третю чашку.
· Після внесення в кожну чашку по 1 мл води в розведеннях 10-2, 10-1 і нерозведеної виливають по 10–12 мл розплавленого и охолодженого до 45ºС МПА. Чашку швидко закривають і круговими рухами перемішують розплавлений МПА з водою. На чашці спеціальним олівцем роблять надписи про дату посіву, розведення, прізвище та групу студента.
· Чашки Петрі перевертають догори дном і ставлять в термостат при температурі 35–37ºС. По кількості колоній, що виросли, з врахуванням розведення роблять висновок про вміст мікроорганізмів в певному об’ємі водопровідної води.
4. Переглянути колонії на чашках Петрі. Колонії, що виросли на твердому живильному середовищі, проглянути спочатку неозброєним оком чи через лупу. Потім помістити чашки на столик мікроскопа нагору дном і вивчити колонії у прохідному світлі з об'єктивом 8х. Відзначити, описати й замалювати переважні форми (3–5 видів), вибираючи ізольовані колонії.
В описі колоній враховують наступні ознаки:
Форму колонії (рис. 4.1) – округла, амебоподібна, ризоїдна, неправильна і т.д.
Структура колонії (рис. 4.2) – однорідна, дрібно- чи грубозерниста, струминна і т.д.
Розмір (діаметр) колонії вимірюють у мм; якщо розміри колонії не перевищує 1 мм, то їх називають крапковими.
Оптичні властивості (блиск і прозорість) колонії – блискуча, матова, тьмяна, борошниста, прозора, напівпрозора, непрозора, флуоресціююча.
Колір колонії – безбарвна (грязно-білі колонії відносять до безбарвних) чи пігментована – біла, жовта, золотава, жовтогаряча, бузкова, червона, чорна і т.д. В описі колоній актиноміцетів відзначають пігментацію повітряного і субстратного міцелію. Особливо відзначають виділення пігменту в субстрат.
Поверхня колонії – гладка, шорсткувата, борозниста (горбиста), складчаста, зморшкувата, із концентричними колами чи радіально покреслена.
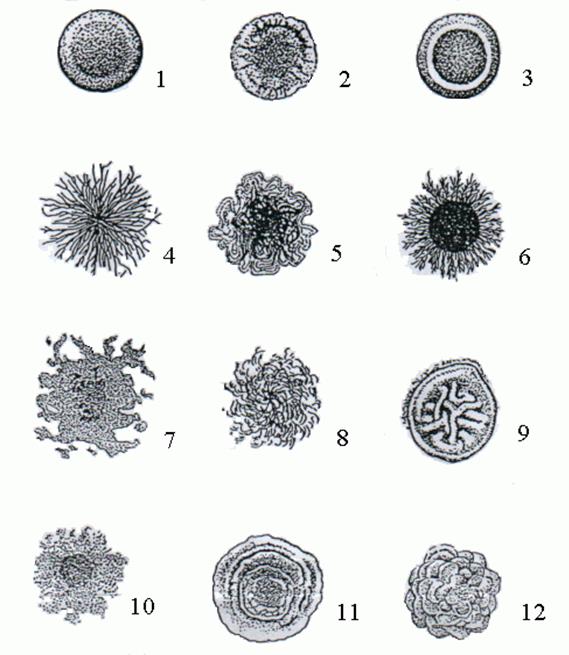
Рис. 4.1. Форма колоній:
1 – кругла; 2 – кругла з фестончастим краєм; 3 – кругла з валиком; 4 і 5 – ризоїдні; 6 – із ризоїдним краєм: 7 – амебоподібна; 8 – нитковидна; 9 – складчаста; 10 – неправильна; 11 – концентрична; 12 – складна.
Профіль колонії (рис. 4.3) – плоский, опуклий, кратероподібний, конусоподібний.
Край колонії (рис. 4.4) – рівний, хвилястий, зубцюватий, торочкуватий і т.д.
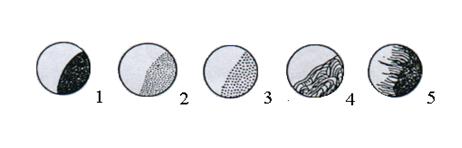
Рис. 4.2. Структура колоній:
1 – однорідна; 2 – дрібнозерниста; 3 – грубозерниста; 4 – струминна; 5 – волокниста.
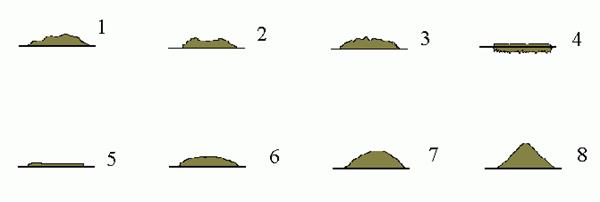
Рис. 4.3. Профіль колонії:
1 – вигнутий; 2 – кратероподібний; 3 – горбистий; 4 – колонія, що вростає у субстрат; 5 – плоский; 6 – опуклий; 7 – краплеподібний; 8 –конусоподібний.
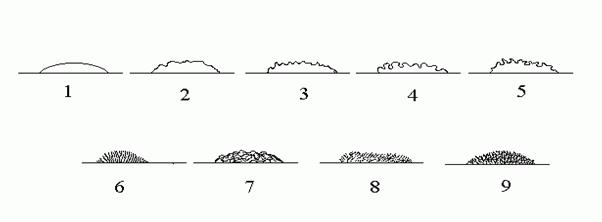
Рис. 4.4. Край колонії:
1 – гладкий; 2 – хвилястий; 3 – зубцюватий; 4 – лопатевий; 5 – неправильний; 6 – війчастий; 7 – нитчастий; 8 – ворсинчастий; 9 – гіллястий.
Консистенцію колонії визначають, доторкаючись до її поверхні петлею. Колонія може легко зніматися з агару, бути густою, м'якою чи такою, що вросла в агар, слизуватою (прилипати до петлі), тягучою, плівчастою (знімається цілком), тендітною (легко ламається за умов дотику петлею).
Край і структуру колонії визначають із невеликим збільшенням мікроскопа. Для цього чашку поміщають на столик мікроскопа кришкою вниз. Консистенцію визначають під час відсівання колоній, доторкаючись до поверхні петлею.
Розміри й деякі інші особливості колоній змінюються з віком і залежать від складу середовища, тому в їхньому описі указують вік культури, склад середовища й температуру культивування.
Здатність до емульгування – рівномірна чи зерниста суспензія у воді, слабко чи зовсім не суспендується у воді.
5. Після опису колонії піддаються мікроскопічному дослідженню. З кожної групи колоній, що виросли на густих середовищах, для вивчення морфології і тинкторіальних властивостей мікроорганізмів приготувати препарати «роздавлена крапля», виконати мазки й забарвити за Грамом. Препарати переглянути з об'єктивами 40х і 90х, відзначити форму й сполучення кліток, наявність чи відсутність спор, визначити, до яких морфологічних груп мікроорганізмів вони відносяться. Мікроскопічну картину замалювати.
 2015-09-06
2015-09-06 692
692








