| соединение | молекулярная теплоемкость |
| PbO AgCL BaCl2 | 5,78 R 6,29 R 9,3 R |
В случае твердых соединений, элементарная ячейка которых состоящих из двух атомов, например KCl, PbO и т.д., молекулярная теплоемкость согласно этому правилу должна равняться 6R, а для твердых соединений, с ячейкой из трех атомов, например CaCl2, PbCl2 и т.д., соответственно 9R. В таблице 1.2 приведены величины молекулярных теплоемкостей некоторых соединений, подтверждающие сформулированное правило.
Как показывает опыт, постоянство теплоемкости твердых тел нарушается при понижении температуры. Теплоемкости твердых тел уменьшаются при понижении температуры, стремясь к нулю при приближении температуры к абсолютному нулю. Вблизи абсолютного нуля молярная теплоемкость всех тел пропорциональна Т3.
Теория теплоемкости твердых тел была создана Эйнштейном и Дебаем. Она учитывает, что колебания частиц в кристаллической решетке не являются независимыми и что энергия колебательного движения квантованна.
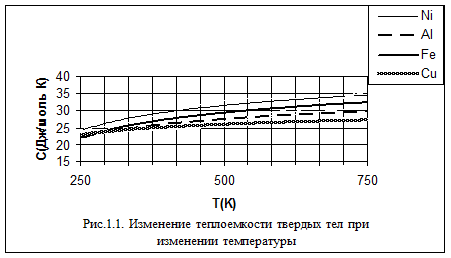
На рисунке 1.1 изображено определенное экспериментальное изменение теплоемкости твердого тела при изменении температуры. Как мы видим, при сравнительно высоких температурах теплоемкость твердого тела не зависит от температуры. Это область применения закона Дюлонга и Пти. При температурах, прилегающих к абсолютному нулю, наблюдается пропорциональность теплоемкости третьей степени температуры T0 – это область, в которой выполняется закон Дебая. Между ними лежит промежуточная область, для которой количественную связь между теплоемкостью и температурой пока установить не удалось.
 2015-09-06
2015-09-06 639
639








