1. При адиабатическом расширении 2 молями одноатомного газа совершена работа, равная 2493 Дж. При этом изменение температуры составило _____ K.
Решение:
Т.к. 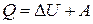 и
и 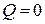 , то
, то 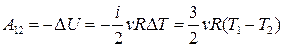 . Следовательно,
. Следовательно, 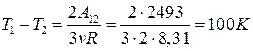
2. Один моль идеального одноатомного газа в ходе некоторого процесса получил 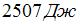 теплоты. При этом его температура понизилась на
теплоты. При этом его температура понизилась на 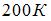 . Работа (
. Работа (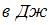 ), совершенная газом, равна …
), совершенная газом, равна … 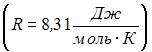
Решение:
1. 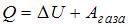 и
и 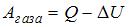 .
.
2. 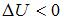 , так как температура понизилась и
, так как температура понизилась и 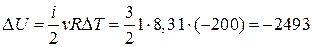 Дж.
Дж.
3. 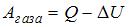 и
и 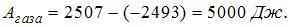
3. При изотермическом расширении 1 моля газа его объем увеличился в 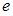 раз (
раз (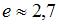 ), работа газа составила 1662 Дж. Тогда температура равна ___200__ K.
), работа газа составила 1662 Дж. Тогда температура равна ___200__ K.
Решение:
При изотермическом расширении работа газа находится по формуле: (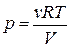 )
) 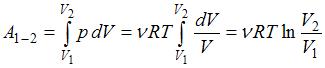 ; следовательно, температура газа равна:
; следовательно, температура газа равна: 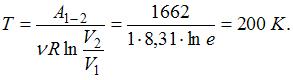
4. При адиабатическом расширении 2 молей одноатомного газа его температура понизилась с 300 К до 200 К, при этом газ совершил работу (в Дж), равную...2493
Решение:
При адиабатическом расширении работа газа находится по формуле:
Т.к. 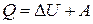 и
и 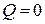 , то
, то 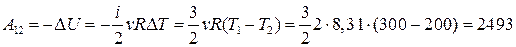 Дж.
Дж.
5. Идеальному одноатомному газу в изобарном процессе подведено количество теплоты 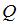 . При этом на увеличение внутренней энергии газа расходуется ________% подводимого количества теплоты.
. При этом на увеличение внутренней энергии газа расходуется ________% подводимого количества теплоты.
Решение:
1. 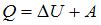 ,
,
2. 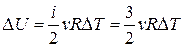
3.Т.к. 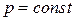 и
и 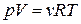 , то
, то 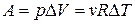 . Тогда
. Тогда 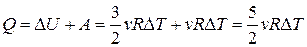
4. 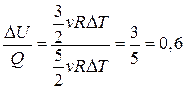 или
или 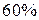
6. Диаграмма циклического процесса идеального одноатомного газа представлена на рисунке. Отношение работы при нагревании к работе газа за весь цикл по модулю равно …
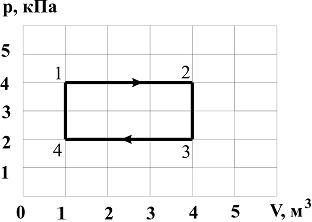
Решение:
Работа – площадь под кривой на 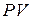 диаграмме.
диаграмме.
1. Работа за цикл – площадь фигуры 1234, положительна и равна 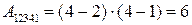 КДж
КДж
2. 1 – 2 Так как 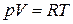 ,
, 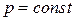 , а
, а 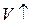 , то и
, то и 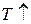 и
и 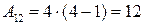 Дж
Дж
2 – 3 Так как 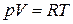 ,
, 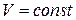 , а
, а 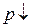 , то и
, то и 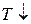
3 – 4 Так как 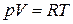 ,
, 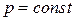 , а
, а 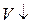 , то и
, то и 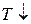
4 – 1 Так как 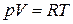 ,
, 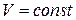 , а
, а 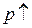 , то и
, то и 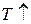 и
и 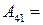 0
0
3. 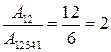
7. На рисунке представлена диаграмма циклического процесса идеального одноатомного газа:
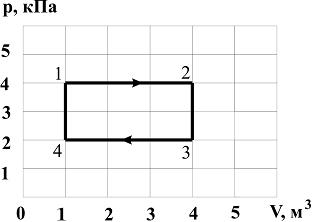
За цикл газ получает количество теплоты (в 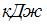 ), равное …
), равное …
Решение:
1. 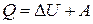 ,
, 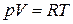 (
(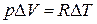 или
или 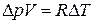 )
)
2. 1 – 2 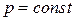 ,
, 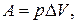
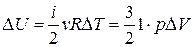 и
и 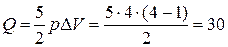 кДж
кДж
2 – 3 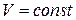 (
(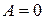 ),
), 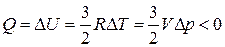
3 – 4 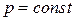 ,
, 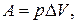
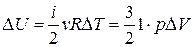 и
и 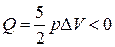
4 – 1 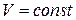 (
(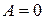 ),
), 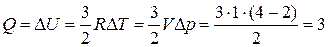 кДж
кДж
3. 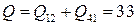 кДж
кДж
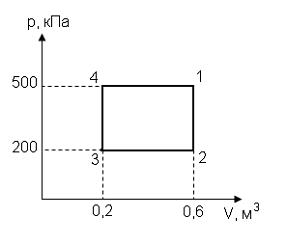
8. На (P,V)-диаграмме изображены два циклических процесса.
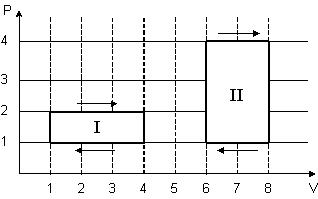
Отношение работ АI/АII, совершенных в этих циклах, равно…
2 -2 -1/2 1/2
Решение:
. Работа – площадь под кривой на 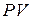 диаграмме.
диаграмме.
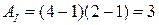 ед. энергии,
ед. энергии, 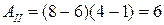 ед. энергии и
ед. энергии и 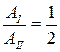
9. Диаграмма циклического процесса идеального одноатомного газа представлена на рисунке. Отношение работы за весь цикл к работе при охлаждении газа равно…
5, 1,5, 2,5, 3
Решение:
10. Одному молю двухатомного газа было передано 5155 Дж теплоты, при этом газ совершил работу, равную 1000 Дж, а его температура повысилась на __200____ K.
Решение:
Согласно первому началу термодинамики 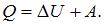 Изменение внутренней энергии
Изменение внутренней энергии 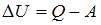 , с другой стороны –
, с другой стороны – 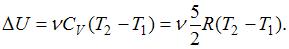
Следовательно, 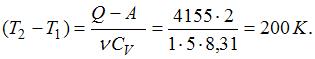
11. Двум молям водорода сообщили 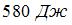 теплоты при постоянном давлении. При этом его температура повысилась на __10____ К.
теплоты при постоянном давлении. При этом его температура повысилась на __10____ К.
(Считать связь атомов в молекуле жесткой. 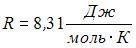 )
)
Ответ округлите до целого числа.
Решение:
Согласно первому началу термодинамики, количество теплоты, получаемое газом, равно 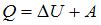 , где
, где 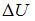 – изменение внутренней энергии,
– изменение внутренней энергии, 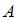 – работа газа. Количество теплоты, сообщаемое газу при постоянном давлении можно представить в виде
– работа газа. Количество теплоты, сообщаемое газу при постоянном давлении можно представить в виде 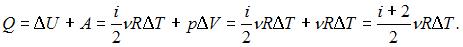 Здесь
Здесь 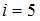 – число степеней свободы молекул двухатомного газа с жесткой связью атомов в молекуле. Отсюда
– число степеней свободы молекул двухатомного газа с жесткой связью атомов в молекуле. Отсюда 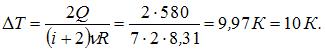
12. Идеальному трехатомному газу (с нелинейными молекулами) в изобарном процессе подведено количество теплоты 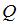 . При этом на работу расширения расходуется __25______% подводимого количества теплоты. (Считать связь атомов в молекуле жесткой.)
. При этом на работу расширения расходуется __25______% подводимого количества теплоты. (Считать связь атомов в молекуле жесткой.)
Решение:
Согласно первому началу термодинамики, 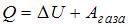 , где
, где 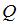 – количество теплоты, полученное газом,
– количество теплоты, полученное газом, 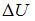 – приращение его внутренней энергии,
– приращение его внутренней энергии, 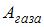 – работа, совершенная газом. Изменение внутренней энергии
– работа, совершенная газом. Изменение внутренней энергии 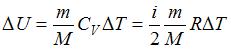 . Работа газа при изобарном процессе
. Работа газа при изобарном процессе 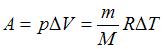 . Тогда
. Тогда 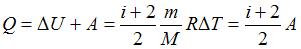 . Доля количества теплоты, расходуемого на работу расширения, составит
. Доля количества теплоты, расходуемого на работу расширения, составит 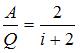 . Для трехатомного газа с жесткой связью атомов в молекуле
. Для трехатомного газа с жесткой связью атомов в молекуле 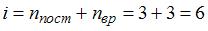 . Следовательно,
. Следовательно, 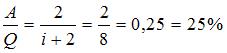 .
.
Тема: Средняя энергия молекул
1. Молярная теплоемкость идеального газа при постоянном давлении равна 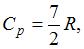 где
где 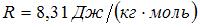 – универсальная газовая постоянная. Число вращательных степеней свободы молекулы равно … 2
– универсальная газовая постоянная. Число вращательных степеней свободы молекулы равно … 2
Решение:
Молярная теплоемкость идеального газа в изобарном процессе определяется соотношением 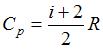 , где
, где 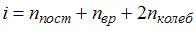 . Здесь
. Здесь 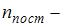 число степеней свободы поступательного движения;
число степеней свободы поступательного движения; 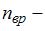 число степеней свободы вращательного движения;
число степеней свободы вращательного движения; 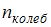 – число степеней свободы колебательного движения. Для молекул идеального газа
– число степеней свободы колебательного движения. Для молекул идеального газа 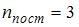 ,
, 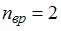 для линейных молекул и
для линейных молекул и 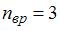 для нелинейных молекул. Из сопоставления с данными задания следует, что
для нелинейных молекул. Из сопоставления с данными задания следует, что 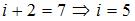 . С учетом того что
. С учетом того что 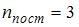 , приходим к выводу, что
, приходим к выводу, что 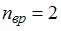 . В данном случае
. В данном случае 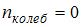 .
.
2. Если не учитывать колебательные движения в молекуле углекислого газа, то средняя кинетическая энергия молекулы равна … 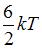
Решение:
Средняя кинетическая энергия молекулы равна: 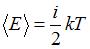 , где
, где 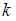 – постоянная Больцмана,
– постоянная Больцмана, 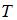 – термодинамическая температура;
– термодинамическая температура; 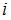 – сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы:
– сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы: 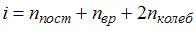 . Для молекулы углекислого газа
. Для молекулы углекислого газа 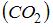 число степеней свободы поступательного движения
число степеней свободы поступательного движения 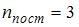 , вращательного –
, вращательного – 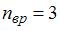 , колебательного –
, колебательного – 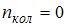 , поэтому
, поэтому 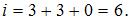
Следовательно, средняя кинетическая энергия молекулы 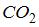 равна:
равна: 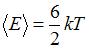 .
.
3. Средняя кинетическая энергия молекул газа при температуре 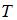 зависит от их конфигурации и структуры, что связано с возможностью различных видов движения атомов в молекуле и самой молекулы. При условии, что имеет место поступательное и вращательное движение молекулы как целого, средняя кинетическая энергия молекулы водяного пара (
зависит от их конфигурации и структуры, что связано с возможностью различных видов движения атомов в молекуле и самой молекулы. При условии, что имеет место поступательное и вращательное движение молекулы как целого, средняя кинетическая энергия молекулы водяного пара (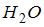 ) равна …
) равна … 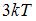
Решение:
Для статистической системы в состоянии термодинамического равновесия на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная 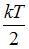 , а на каждую колебательную степень –
, а на каждую колебательную степень – 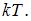 Средняя кинетическая энергия молекулы равна:
Средняя кинетическая энергия молекулы равна: 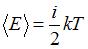 . Здесь
. Здесь 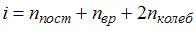 , где
, где 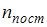 – число степеней свободы поступательного движения,
– число степеней свободы поступательного движения, 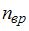 – число степеней свободы вращательного движения,
– число степеней свободы вращательного движения, 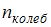 – число степеней свободы колебательного движения. Для молекул идеального газа
– число степеней свободы колебательного движения. Для молекул идеального газа 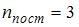 ,
, 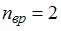 для линейных молекул и
для линейных молекул и 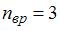 для нелинейных молекул. Молекула водяного пара является нелинейной, поэтому для нее
для нелинейных молекул. Молекула водяного пара является нелинейной, поэтому для нее 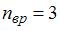 . Поскольку по условию имеет место поступательное и вращательное движение молекулы как целого,
. Поскольку по условию имеет место поступательное и вращательное движение молекулы как целого, 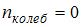 . Таким образом,
. Таким образом, 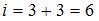 . Тогда средняя энергия молекулы водяного пара (
. Тогда средняя энергия молекулы водяного пара (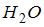 ) равна:
) равна: 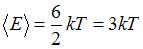 .
.
4. Средняя кинетическая энергия молекулы идеального газа при температуре T равна 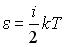 . Здесь
. Здесь 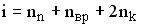 , где
, где 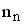 ,
, 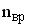 и
и 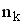 – число степеней свободы поступательного, вращательного и колебательного движений молекулы. Для атомарного водорода число i равно …
– число степеней свободы поступательного, вращательного и колебательного движений молекулы. Для атомарного водорода число i равно …
1, 5, 7, 3
Решение:
5. В соответствии с законом равномерного распределения энергии по степеням свободы средняя кинетическая энергия молекулы идеального газа при температуре T равна: 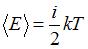 . Здесь
. Здесь 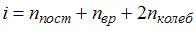 , где
, где 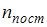 ,
, 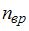 и
и 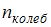 – число степеней свободы поступательного, вращательного и колебательного движений молекулы соответственно. Для водорода (
– число степеней свободы поступательного, вращательного и колебательного движений молекулы соответственно. Для водорода (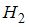 ) число i равно … 7
) число i равно … 7
Решение:
Для статистической системы в состоянии термодинамического равновесия на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная 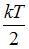 , а на каждую колебательную степень –
, а на каждую колебательную степень – 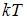 . Средняя кинетическая энергия молекулы равна:
. Средняя кинетическая энергия молекулы равна: 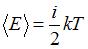 . Здесь
. Здесь 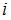 – сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы:
– сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы: 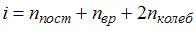 , где
, где 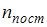 – число степеней свободы поступательного движения, равное 3;
– число степеней свободы поступательного движения, равное 3; 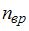 – число степеней свободы вращательного движения, которое может быть равно 0, 2, 3;
– число степеней свободы вращательного движения, которое может быть равно 0, 2, 3; 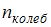 – число степеней свободы колебательного движения, минимальное количество которых равно 1.
– число степеней свободы колебательного движения, минимальное количество которых равно 1.
Для водорода (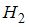 ) (двухатомной молекулы)
) (двухатомной молекулы) 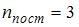 ,
, 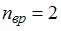 и
и 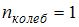 . Следовательно,
. Следовательно, 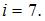
6. Газ занимает объем 5 л под давлением 2 МПа. При этом кинетическая энергия поступательного движения всех его молекул равна … 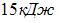
Решение:
Согласно уравнению кинетической теории для давления идеального газа (основному уравнению МКТ идеальных газов), произведение давления идеального газа и его объема равно двум третям энергии поступательного движения всех его молекул: 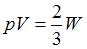 . Отсюда
. Отсюда 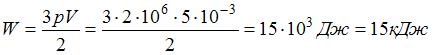
7. Если не учитывать колебательные движения в молекуле водорода при температуре 200 К, то кинетическая энергия в (Дж) всех молекул в 4 г водорода равна … 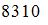
Решение:
Средняя кинетическая энергия одной молекулы равна: 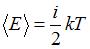 , где
, где 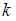 – постоянная Больцмана,
– постоянная Больцмана, 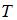 – термодинамическая температура;
– термодинамическая температура; 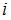 – сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы
– сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы 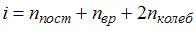 . Молекула водорода
. Молекула водорода 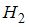 имеет 3 поступательные и 2 вращательные степени свободы, следовательно,
имеет 3 поступательные и 2 вращательные степени свободы, следовательно, 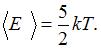 В 4 г водорода содержится
В 4 г водорода содержится 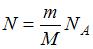 молекул, где
молекул, где 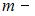 масса газа,
масса газа, 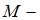 молярная масса водорода,
молярная масса водорода, 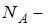 число Авогадро. Кинетическая энергия всех молекул будет равна:
число Авогадро. Кинетическая энергия всех молекул будет равна: 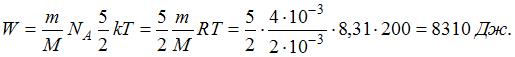
8. Отношение средней кинетической энергии вращательного движения к средней энергии молекулы с жесткой связью 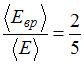 . Это имеет место для …
. Это имеет место для …
 | водорода | ||
| водяного пара | |||
| гелия | |||
метана (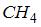 ) ) |
Решение:
Средняя кинетическая энергия молекулы равна: 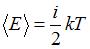 , где
, где 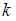 – постоянная Больцмана,
– постоянная Больцмана, 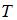 – термодинамическая температура,
– термодинамическая температура, 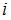 – сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы:
– сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы: 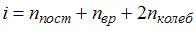 . Средняя энергия вращательного движения
. Средняя энергия вращательного движения 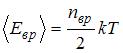 . Таким образом, с учетом того что связь атомов в молекуле по условию является жесткой (в этом случае
. Таким образом, с учетом того что связь атомов в молекуле по условию является жесткой (в этом случае 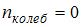 ), отношение
), отношение 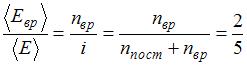 . Отсюда
. Отсюда 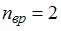 , что имеет место для газов с двухатомными и многоатомными линейными молекулами. Следовательно, это – водород.
, что имеет место для газов с двухатомными и многоатомными линейными молекулами. Следовательно, это – водород.
9. При комнатной температуре коэффициент Пуассона 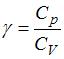 , где
, где 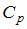 и
и 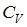 – молярные теплоемкости при постоянном давлении и постоянном объеме соответственно, равен
– молярные теплоемкости при постоянном давлении и постоянном объеме соответственно, равен 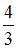 для …
для …
 | водяного пара | ||
| водорода | |||
| азота | |||
| гелия |
Решение:
Из отношения 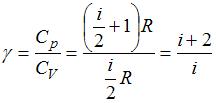 . При комнатной температуре
. При комнатной температуре 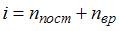 , где
, где 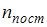 и
и 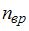 – число поступательных и вращательных степеней свободы. По условию
– число поступательных и вращательных степеней свободы. По условию 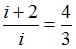 . Отсюда
. Отсюда 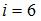 . Так как для молекул газа
. Так как для молекул газа 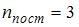 , то для рассматриваемого газа
, то для рассматриваемого газа 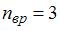 , а три вращательные степени свободы имеют трехатомные и многоатомные газы с нелинейными молекулами. Следовательно, речь идет о водяном паре
, а три вращательные степени свободы имеют трехатомные и многоатомные газы с нелинейными молекулами. Следовательно, речь идет о водяном паре
10. Средняя кинетическая энергия молекул газа при температуре 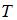 зависит от их конфигурации и структуры, что связано с возможностью различных видов движения атомов в молекуле и самой молекулы. При условии, что имеет место поступательное, вращательное движение молекулы как целого и колебательное движение атомов в молекуле, отношение средней кинетической энергии колебательного движения к полной кинетической энергии молекулы азота (
зависит от их конфигурации и структуры, что связано с возможностью различных видов движения атомов в молекуле и самой молекулы. При условии, что имеет место поступательное, вращательное движение молекулы как целого и колебательное движение атомов в молекуле, отношение средней кинетической энергии колебательного движения к полной кинетической энергии молекулы азота (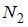 ) равно …
) равно … 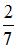
Решение:
Для статистической системы в состоянии термодинамического равновесия на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная 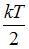 , а на каждую колебательную степень –
, а на каждую колебательную степень – 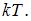 Средняя кинетическая энергия молекулы равна:
Средняя кинетическая энергия молекулы равна: 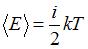 . Здесь
. Здесь 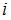 – сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы:
– сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы: 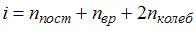 , где
, где 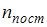 – число степеней свободы поступательного движения, равное 3;
– число степеней свободы поступательного движения, равное 3; 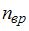 – число степеней свободы вращательного движения, которое может быть равно 0, 2, 3;
– число степеней свободы вращательного движения, которое может быть равно 0, 2, 3; 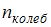 – число степеней свободы колебательного движения, минимальное количество которых равно 1.
– число степеней свободы колебательного движения, минимальное количество которых равно 1.
Для молекулярного азота (двухатомной молекулы) 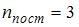 ,
, 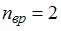 и
и 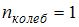 . Следовательно,
. Следовательно, 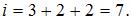 Полная средняя кинетическая энергия молекулы азота (
Полная средняя кинетическая энергия молекулы азота (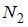 ) равна:
) равна: 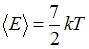 , энергия колебательного движения
, энергия колебательного движения 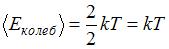 , тогда отношение
, тогда отношение 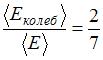 .
.
11.Средняя кинетическая энергия молекул газа при температуре Т зависит от их структуры, что связано с возможностью различных видов движения атомов в молекуле. Средняя кинетическая энергия молекул гелия (He) равна …
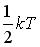 ,
, 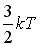 ,
, 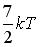 ,
, 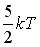
Решение:
12. Отношение средней кинетической энергии вращательного движения к средней энергии молекулы с жесткой связью 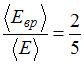 . Это имеет место для …
. Это имеет место для …
 | водорода | ||
| водяного пара | |||
| гелия | |||
метана (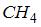 ) ) |
Решение:
Средняя кинетическая энергия молекулы равна: 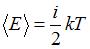 , где
, где 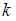 – постоянная Больцмана,
– постоянная Больцмана, 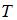 – термодинамическая температура,
– термодинамическая температура, 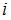 – сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы:
– сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы: 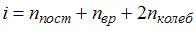 . Средняя энергия вращательного движения
. Средняя энергия вращательного движения 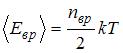 . Таким образом, с учетом того что связь атомов в молекуле по условию является жесткой (в этом случае
. Таким образом, с учетом того что связь атомов в молекуле по условию является жесткой (в этом случае 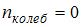 ), отношение
), отношение 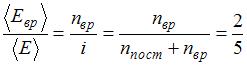 . Отсюда
. Отсюда 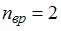 , что имеет место для газов с двухатомными и многоатомными линейными молекулами. Следовательно, это – водород.
, что имеет место для газов с двухатомными и многоатомными линейными молекулами. Следовательно, это – водород.
13. При комнатной температуре отношение 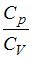 молярных теплоемкостей при постоянном давлении и постоянном объеме равно
молярных теплоемкостей при постоянном давлении и постоянном объеме равно 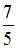 для …
для …
 | кислорода | ||
| водяного пара | |||
| углекислого газа | |||
| гелия |
Решение:
Из отношения 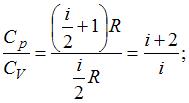
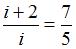 найдем
найдем 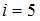 ,
, 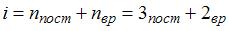 . Так как 3 поступательные и 2 вращательные степени свободы имеют двухатомные газы, следовательно, это кислород.
. Так как 3 поступательные и 2 вращательные степени свободы имеют двухатомные газы, следовательно, это кислород.
 2015-09-06
2015-09-06 2725
2725