Большинство токсинов являются водорастворимыми глобулярными белками и внешне представляют собой твердые вещества, чаще всего имеющие вид аморфного порошка от белого до желто-коричневого цвета. Лишь некоторые экзотоксины выделены в кристаллическом состоянии. Все токсины термически нестойки, не перегоняются и не могут быть охарактеризованы температурами плавления.
Обычно порошкообразные токсины активно связывают воду с образованием гелей или высоковязких водных растворов. В органических растворителях токсины не растворяются, хотя кристаллы экзотоксинов, выращенные из водных растворов, содержащих органический растворитель, включают молекулы последнего, так что удаление растворителя сопровождается потерей кристалличности.
Эндотоксины, как правило, комплексы полипептидов с полисахаридами или липидами. Большинство экзотоксинов — высокомолекулярные полипептиды. В связи с этим для характеристики строения токсинов используются различные описательные возможности, отражающие тот или иной уровень структурной сложности полипептидов: первичный, вторичный, третичный, четвертичный.
Первичная структура токсинов, подобно всем природным белкам, описывается общей формулой:
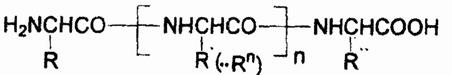
где R—Rn — остатки 20 различных белокобразующих α-аминокислот H2NCH(R)COOH, т.е. Н или алкилы, которые могут быть замещены арилами, окси-, меркапто-, амино-, имино-, амидино-, карбоксигругруппами, карбамилом или гетероциклическими радикалами. Первичная структура характеризует набор, количество аминокислотных звеньев в молекуле токсина и последовательность их сцепления. Все аминокислоты связываются в полипептидную цепь по единому образцу путем конденсации: аминогруппа одной аминокислоты и карбокси-группа другой генерируют молекулу воды, а за счет освободившихся валентностей остатки аминокислот соединяются:
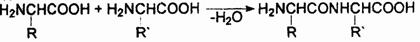
Между сконденсированными аминокислотами возникает прочная ковалентная связь —СО—NH—, называемая пептидной связью. Образующееся соединение называется пептидом. Из двух аминокислот образуется дипептид, из трех — трипептид, из нескольких — олигопептид, из многих — полипептид. В состав молекул токсинов входят многие сотни — тысячи аминокислотных остатков, следовательно, все токсины — полипептиды.
Линейный размер каждого аминокислотного звена составляет примерно 0,3 нм. Молекула линейно построенного полипептида должна была бы представлять собой достаточно длинную цепь. В действительности же она имеет вид компактной частицы (глобулы), что объясняется особой пространственной организацией таких регулярно построенных биополимеров, описываемой вторичной и третичной структурами. Во вторичной структуре белковая цепь закручивается за счет свободного вращения вокруг С—С-связей в спираль, как бы навитую на цилиндр. Спираль стабилизируется путем образования водородных связей между кислородом СО-групп и водородом NH-групп на соседних витках, идущих по образующей цилиндра. Хотя водородные связи относительно слабы, но, повторенные многократно, они обеспечивают достаточно прочное сцепление. Полипептидная спираль, «прошитая» многочисленными водородными связями, представляет собой довольно устойчивую пространственную структуру с фиксированным размещением заместителей R.
Наличие различных фиксированных на «поверхности» спирали функциональных групп в молекуле полипептида обусловливает возможность последующего взаимодействия между ними, в результате которого спич раль за счет своей гибкости свертывается в клубок (глобулу), получивший название третичной структуры. Это объемное структурное образование с характерной для каждого токсина поверхностью получило название конформации. Наиболее часто клубок скрепляется дисульфидными мостиками — ковалентными S—S-связями, которые возникают при окислении меркаптогрупп в заместителях R аминокислот, расположенных на отдаленных друг от друга участках полипептидной цепи:
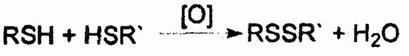
Иногда для фиксации клубка достаточно «сшить» изогнутую спираль одним или несколькими дисульфидными мостиками. Дополнительно этому способствуют водородные, ионные, гидрофобные и иные слабые связи. Считают, что именно конформадия обусловливает физиологическую активность и реакционную способность токсинов, равно как и биокаталитическую активность белков-ферментов.
Многие токсины представляют собой «агрегаты», сформированные из нескольких глобул полипептидов с определенной третичной структурой. Каждая из этих глобул, являющихся как бы полипептидными фрагментами токсина, синтезируется под контролем различных генов и называется субъединицей токсина или доменом. При описании свойств таких токсинов, как «агрегатов» нескольких доменов, обычно используется понятие четвертичной структуры. Эта структура поддерживается как ковалентными, в частности дисульфидными связями, так и непрочными гидрофобными связями, т. е. силами сцепления между неполярными заместителями многих аминокислот. Хотя гидрофобные силы сцепления относятся к слабейшим связям, в сумме они благодаря многочисленности дают значительную энергию взаимодействия.
Четвертичной структурой описывают также комплексы полипептидов третичной структуры со сравнительно низкомолекулярными непептидными соединениями, встречающиеся в химии токсинов.
Естественно, что нарушение конформации токсина может привести к изменению его реакционной способности и к потере токсичности. Это может быть не только изменение природы функциональных групп К реакционного центра, но и восстановление дисульфидных мостиков, а иногда даже извращение уровня слабых взаимодействий (водородных, ионных, гидрофобных). В одних случаях нарушение конформации токсина обратимо (денативация), в других — необратима (денатурация).
Денативация полипептидов третичной или четвертичной структуры наблюдается, например, при незначительном и кратковременном нагревании, при контакте с разбавленными щелочами и кислотами, при обработке растворами солей и некоторых органических соединений. В этих случаях имеет место обратимое и частичное извращение конформации, например частичное развертывание спирали, что сопровождается изменениями физических свойств полипептида: снижением уровня гидратации, уменьшением растворимости в воде, увеличением вязкости растворов.
Денатурация полипептидов имеет место при длительном и значительном нагревании, при ионизирующем или ультрафиолетовом облучении, при обработке концентрированными щелочами и кислотами, а также окислительно-хлорирующими реагентами и растворами формальдегида. Денатурация обычно сопровождается разрывом одних и образованием других, новых ковалентных связей в молекуле полипептида, в итоге изменяется природа реакционных центров молекулы и извращается ее физиологическая активность. Иными словами, денатурация токсинов ведет к снижению или полной потере ими токсичности, что используется для их уничтожения. Токсины гидролизуются с разрывом пептидных связей и образованием нетоксичных фрагментов полипептидной цепи разной величины или даже отдельных аминокислот.
Скорость гидролиза зависит от температуры, рН среды, соотношения кислотных и основных групп в молекуле. Медленный гидролиз происходит уже при хранении водных растворов токсинов при комнатной температуре, в связи с чем токсичность растворов постепенно снижается, гидролиз ускоряется протеолитическими ферментами (протеазами).
Окислители и вещества окислительно-хлорирующего действия (хлорамины, Ишохлориты, перманганат калия) лишают токсины физиологической активности, |ревидно, за счет окисления азота в индольном кольце аминокислоты триптофана:
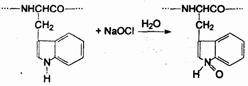
Альдегиды и некоторые кетоны также пригодны для инактивации токсинов. Они взаимодействуют с концевыми и боковыми аминогруппами пептидов с образованием оснований Шиффа.
При обработке токсинов формалином (водным раствором формальдегида) нередки случаи «сшивания» полипептидных цепей:
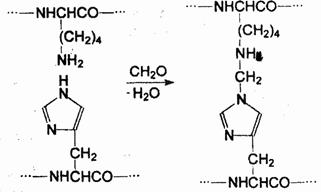
Характерно, что в то время как биоактивность токсинов при конденсации с формальдегидом исчезает, антигенность продуктов конденсации остается достаточной, чтобы вызвать формирование иммунозашитного ответа организма — образование антител, нейтрализующих исходный токсин. Именно таким способом и получают анатоксины.
Токсины обладают свойством флюоресценции в ультрафиолетовом свете, что может быть использовано для их неспецифической индикации. Считают, что флюоресценция зависит от наличия в молекулах токсинов определенных аминокислот H2NCH(R)COOH, где R — 3-ин-долилметил (триптофан), С6Н5СН2 (фенилаланин), 4-НОС6Н4СН2 (тирозин).
Для обнаружения токсинов пригодны многочисленные цветные реакции белков: на наличие пептидных связей в молекуле, на любые или какие-то конкретные аминокислоты. Все эти реакции неспецифичны.
 2015-09-06
2015-09-06 742
742








