Для определения отношения С p / C v воздуха в данной лабораторной работе применен метод, предложенный Клеманом и Дезормом, в котором использовано охлаждение газа при его адиабатическом расширении.
Лабораторный стенд состоит из насоса и баллона, наполненного воздухом и соединенного с манометром (рис. 1).
Посредством крана баллон может сообщаться с атмосферой. В начале эксперимента давление воздуха в баллоне равно атмосферному, а его температура Т ОКР равна температуре окружающей среды.
Открыв кран, с помощью насоса можно подкачать в баллон некоторое количество воздуха, в результате чего давление в баллоне повысится до некоторого значения p 1. После подкачки следует подождать примерно минуту: за это время в результате теплообмена через стенки температура воздуха внутри баллона опять сравняется с температурой наружного воздуха. Рассматриваемая нами порция газа массой m займёт объём V 1, то есть будет сжата остальной частью воздуха. Этому состоянию данной части газа соответствует точка 1 на рис. 2.
После того как давление газа в баллоне установилось, быстро выпускаем часть газа из сосуда, после чего сосуд закрываем. Давление в сосуде (и в выделенной порции газа) упадёт до р 2.
При адиабатическом расширении температура рассматриваемой части газа понижается (см. формулу (9): положительному dV в ней должно соответствовать отрицательное dT). На рис. 2 данный процесс представлен гиперболой 1-2; конечному состоянию газа соответствует точка 2.
С течением времени температура газа в баллоне повысится: из-за теплопроводности стенок температура воздуха внутри баллона вновь станет равной температуре Т ОКР окружающей среды. Это состояние представлено точкой 3 на рис. 2.
Таким образом, процесс перехода выделенной нами части газа массой m из состояния 1 в состояние 2 происходит адиабатически, а из состояния 2 в состояние 3 изохорически. Точки 1 и 3 диаграммы лежат на одной изотерме. Измерив давление газа в точках 1, 2 и 3, можно вычислить показатель степени в уравнении Пуассона для адиабаты – отношение С p / C v.
Согласно уравнению Пуассона при переходе из состояния 1 в состояние 2 должно выполняться условие:
р 1 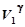 = р 2
= р 2 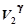 . (17)
. (17)
Точки 1 и 3 лежат на одной изотерме, следовательно,
р 1 V 1 = р 3 V 2 . (18)
Возведём правую и левую части равенства (18) в степень g, после чего почленно поделим результат на равенство (17). Получим:
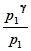 =
= 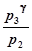 , или (19)
, или (19)
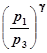 =
= 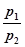 . (20)
. (20)
После логарифмирования приходим к выражению
g 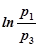 =
= 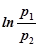 , (21)
, (21)
g = 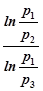 . (22)
. (22)
 2015-09-06
2015-09-06 294
294








