Концентрация фермента оказывает существенное влияние на скорость ферментативной реакции. При насыщающей концентрации субстрата, обеспечивающей Vmov, начальная скорость ферментативной реакции будет, в первую очередь, зависеть от концентрации фермента. Эта зависимость прямопропорциональная, что свидетельствует о том, что начальная скорость является мерой количества фермента. Графически это представлено на рис. 8.5.
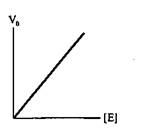 |
Рис. 8.5. Влияние концентрации фермента [Е] на скорость ферментативной реакции (V0)
В)Влияние температуры на активность ферментов. Общий вид кривой, характеризующей влияние температуры на активность фермента, можно представить в виде графика (см. рис. 8.6).
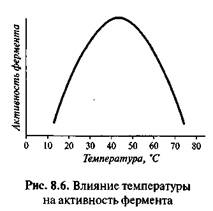 |
Оптимальная температура, при которой наблюдается максимальная активность, для большинства ферментов находится в пределах 37—50°С, но некоторые ферменты имеют температурный оптимум за пределами этой зоны.
Влияние температуры на активность фермента, которое может быть легко изучено экспериментально, имеет очень сложный характер, так как обусловлено целым рядом факторов, а именно: — влиянием температуры на скорость расщепления комплекса ES на свобод-
ный фермент и продукт реакции, т. е. на константу скорости реакции к+2;
— влиянием температуры на сродство фермента к субстрату,
—влиянием на теплоту ионизации, а, следовательно, на процессы иони-
зации всех компонентов реакции: самого фермента, субстрата, про
межуточных и конечных продуктов реакции;
—влиянием на образование таких соединений, как «фермент—актива
тор» или «фермент—ингибитор»;
—влиянием на процесс денатурации ферментного белка.
Термостабильность фермента складывается как бы из двух критериев: величины температуры и времени ее воздействия на фермент. Кроме того, на термостабильность различных ферментов могут оказывать влияние и такие факторы, как рН среды, ее солевой состав, защитное действие субстрата.
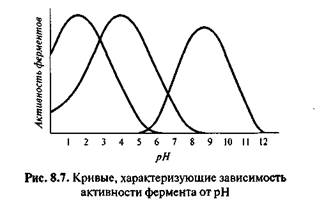
Влияние рН на активность ферментов. Для каждого фермента характерна определенная узкая область значений рН, при которой он проявляет максимальную активность (см. рис. 8.7).
рН влияет на состояние ионизации активного центра фермента, ход представленных кривых будет зависеть и от других факторов. В частности, изменение рН среды изменяет состояние ионизации субстрата (если это заряженное вещество), комплексов ES и ЕР, в некоторых, например, окислительно-восстановительных реакциях, ионы Н+ сами могут принимать участие в реакции; помимо этого, скорость денатурации ферментативного белка зависит от рН.
При экспериментальном изучении активности фермента от рН следует помнить, что рН-оптимум зависит от состава среды (от природы используемого буфера); оптимумы рН прямой и обратной реакции могут быть совершенно различными; при действии одного и того же фермента на различные субстраты рН-оптимумы также могут быть различными. Кроме понятия оптимума рН, очень важным является понятие рН-стабильности. Это тот диапазон рН, при котором фермент или ферментативный препарат сохраняет свою активность в течение определенного периода времени. рН-Стабильность также зависит от ряда факторов, среди которых, кроме уже названных, форма ферментного препарата, степень его очистки и др.
 |
где k — константа скорости реакции; Т — абсолютная температура, °К; Е — энергия активации; R — универсальная газовая постоянная.
 2015-09-06
2015-09-06 1425
1425
