Внутренняя энергия U – термодинамическая функция состояния системы, включающая энергию поступательного и вращательного движения молекул, энергию внутримолекулярного колебательного движения атомов и атомных групп, составляющих молекулу, энергию вращения электронов в атомах, энергию, заключающуюся в ядрах атомов, и другие виды энергии, но без учета кинетической энергии тела в целом и его потенциальной энергии положения.
Энтальпия Н – теплосодержание системы, определяется соотношением
H = U + р∙V,
где р − давление, V – объем системы.
Тепловой эффект химической реакции ∆H = H2 – H1.
В изобарно-изотермических условиях тепловой эффект не зависит от пути перехода и однозначно определяется начальным и конечным состоянием системы.
36 Эндотермические и экзотермические процессы.
Экзотермические реакции.
Известно множество реакций, при протекании которых выделяется энергия. Энергия выделяется, как правило, в виде теплоты.
Экзотермическая реакция – химическая реакция, при которой происходит выделение теплоты. 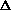 r Hо<0 r Hо<0
|
Кроме экзотермических реакций возможны реакции, при протекании которых теплота поглощается, и, если ее не подводить, то реакционная система охлаждается. Такие реакции называют эндотермическими.
| Эндотермическая реакция – химическая реакция, при которой происходит поглощение теплоты. |
Тепловой эффект таких реакций положительный. Например:
CaCO3(кр) = CaO(кр) +CO2(г), 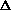 r Hо>0
r Hо>0
2HgO(кр) = 2Hg(ж) + O2(г), 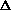 r Hо>0
r Hо>0
2AgBr(кр) = 2Ag(кр) + Br2(г), 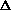 r Hо>0.
r Hо>0.
 2015-09-06
2015-09-06 515
515








