Ферментативный гидролиз крахмала и гликогена осуществляется с помощью ферментов класса гидролаз, подкласса карбогидраз, называемых амилазами: a-амилазы, b-амилазы и глюкоамилазы. Различаются они по свойствам, распространению в природе и способу действия на крахмал. Наиболее активные амилазы содержатся в слюне и соке поджелудочной железы животных и человека, в плесневых грибах, проросшем зерне. Обычно препараты амилазы получают из высушенного проросшего зерна (солод).
Амилазы гидролизуют как неизмененные крахмальные зерна, так и крахмальный клейстер. Атакуемость крахмала амилазами увеличивается с уменьшением размеров крахмальных зерен, т.е. с увеличением их относительной поверхности. Она резко возрастает при механическом нарушении стуктуры крахмальных зерен. Действие амилаз усиливается на клейстеризованный крахмал. Поэтому в целом ряде отраслей пищевой промышленности, например, спиртовой, осахаривание крахмала солодом производится лишь после заваривания муки или измельченного картофеля.
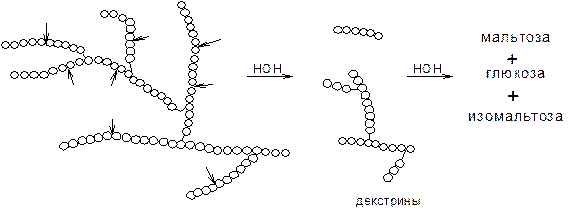
a-амилаза – фермент, гидролизующий a-(1®4)-гликозидные связи внутри молекулы амилозы или амилопектина без определенного порядка. В результате образуются продукты неполного гидролиза крахмала – a-декстрины – полисахариды разной молекулярной массы.
В соотвествии со свойствами различают следующие виды декстринов:
1. амилодекстрины – окрашиваются раствором йода в фиолетово-синий цвет;
2. эритродекстрины, окрашиваются йодом в красно-бурый цвет;
3. ахродекстрины – окрашиваются йодом в слабо-желтый цвет;
4. мальтодекстрины – не дают окрашивания с йодом.
a-амилазу называют декстринирующим ферментом. Она не расщепляет a-(1®6) гликозидные связи.
При действием a-амилазы на амилозу можно получить при полном гидролизе около 85% мальтозы и 15% глюкозы, при действии на амилопектин – около 70% мальтозы, 10% изомальтозы (молекулы глюкозы связаны a-(1®6) гликозидной связью) и 20% глюкозы.
Схематически действие a-амилазы на крахмал можно представить:
а)амилоза:
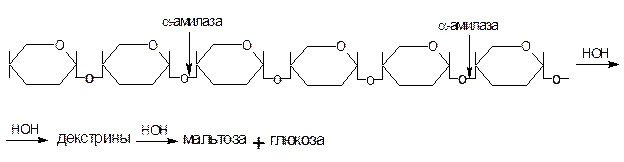
б) амилопектин
b-амилаза – фермент, который катализирует гидролиз крахмала и гликогена по a(1®4) гликозидной связи с нередуцирующих концов молекул. Она не расщепляет a(1®6) связи. В отличие от a-амилазы, b-амилаза действует упорядоченно и, начиная с нередуцирующего конца, отщепляет по молекуле мальтозы.
Амилозу b-амилаза расщепляет нацело, превращая ее на 100% в мальтозу. Если субстратом для действия b-амилазы служит амилопектин, то она расщепляет его на мальтозу и продукт неполного гидролиза, получивший название b-амилодекстрин, на оставшихся ответвлениях которого находятся a(1®6) гликозидные связи. Предельный декстрин гидролизуется b-амилазой только в том случае, если в реакционную смесь добавить a-амилазу. При совместном действии a- и b-амилаз на крахмал около 95% его превращается в мальтозу. Схема гидролиза крахмала под действием b-амилазы выглядит следующим образом:
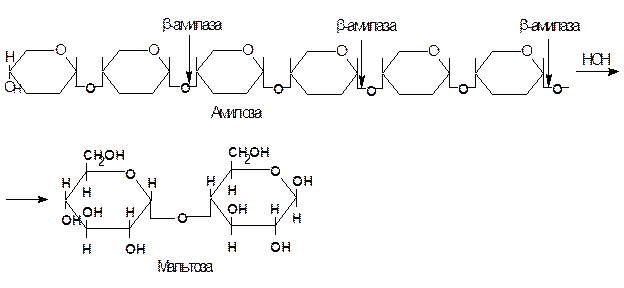
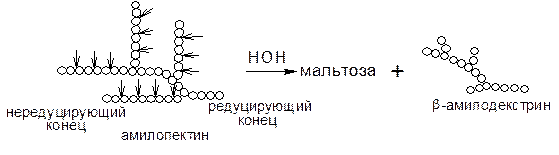
a- и b-амилазы различаются по своему отношению к реакции среды: a-амилаза гораздо более чувствительна к подкислению. Отличаются эти ферменты также по термостабильности и температурному оптимуму: a-амилаза более устойчива к действию повышенных температур, ее температурный оптимум (~70°С) лежит несколько выше, чем оптимум b-амилазы (50~60°С).
Амилазы имеют большое значение в хлебопекарной, пивоваренной, спиртовой промышленности. Брожение теста и накопление в нем СО2, разрыхляющего его и придающего хлебу равномерную пористость и хороший объем, зависят от присутствия в тесте сбраживаемых дрожжами сахаров. В свою очередь, содержание сахара в тесте зависит не только от количества сахара, находящегося в муке, но также от скорости накопления мальтозы при действии амилазы на крахмал. С другой стороны, слишком энергичное действие a-амилазы, имеющейся в большом количестве в муке из проросшего пшеничного или ржаного зерна, вызывает избыточное накопление в тесте декстринов, придающих мякишу хлеба плохую эластичность, заминаемость, недостаточную пористость и неприятный вкус.
Поскольку a-амилаза весьма чувствительна к повышению кислотности и резко понижает при этом свою активность, то тесто надо замешивать на так называемых жидких дрожжах или молочнокислых заквасках. Это обеспечивает накопление в тесте повышенного количества молочной кислоты, угнетающей a-амилазу и нежелательное образование декстринов.
Напротив, в пивоваренной промышленности конечные декстрины необходимы в сусле, поскольку в дальнейшем создают полноту вкуса пива, в определенной степени обусловливают его пеностойкость.
Глюкоамилаза – фермент, действующий с нередуцирующих концов амилозы и амилопектина, отщепляет молекулу глюкозы. Глюкоамилаза расщепляет не только a-1,4-, но и a-1,6-гликозидные связи. Амилоза и амилопектин полностью превращаются в глюкозу.
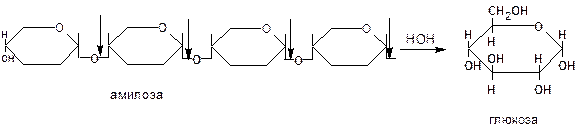

Глюкоамилаза встречается у микромицетов рода Aspergillus, Rhizopus, из которых производятся промышленные препараты глюкоамилазы. Применяется глюкоамилаза в крахмалопаточной промышленности для получения глюкозы и глюкозной патоки.
В молекуле амилопектина расщепление α(1→6)-связей катализирует амилопектин-1,6-глюкозидаза, которая действует на точки ветвления.
В результате совместного действия этих ферментов происходит полныйгидролиз крахмала до глюкозы.
 2015-09-06
2015-09-06 13735
13735
