Образование ионов в растворах электролитов является результатом ионизации. Ионизация – это процесс образования свободных ионов. Разновидностями ионизации являются
– перенос протонов от молекул кислот к молекулам воды:
CH3COOH + H2O CH3COO– + H3O+
– перенос протонов от молекул воды к молекулам оснований:
NH3 + H2O NH4+ + OH–
– растворение веществ с ионными кристаллическими структурами:
NaCl(кр) Na+(aq) + Cl–(aq)
– диссоциация молекул на ионы:
[Pt(NH3)2(NO2)Cl] + H2O [Pt(NH3)2(NO2)H2O] + Cl–
Фактически, диссоциация молекул является относительно редким процессом, и наблюдается преимущественно в комплексных соединениях. На практике, продолжается употребление терминов диссоциация, степень диссоциации, предложенных Аррениусом для всех видов ионизации.
Степенью диссоциации (ионизации) α называется отношение концентрации той части вещества, которая находится в виде ионов, к общей концентрации вещества:
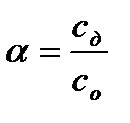
Степень диссоциации зависит от концентрации, и всегда увеличивается при разбавлении раствора. Для сравнения силы электролитов по степени диссоциации обычно берут растворы с концентрацией 0,1 моль/л.
Различают истинную степень диссоциации (αист), являющуюся результатом установления равновесия между молекулами и ионами, и кажущуюся степень диссоциации (αкаж), связанную с межионным торможением. Как истинная, так и кажущаяся степень диссоциации в разных соотношениях могут накладываться у любых электролитов. По преобладанию одного из двух механизмов различают сильные и слабые электролиты.
 2015-10-16
2015-10-16 261
261








