1. Термодинамика растворения.
Раствор – это конденсированная гомогенная система, состав которой можно непрерывно изменять в определенных пределах.
Встречается ограниченная растворимость от 0 до s (B), (В – растворенное вещество, А – растворитель),
и неограниченная растворимость:
мольная доля Х(В) от 0 до 1
одновременно мольная доля Х(А) от 1 до 0
Возможность образования раствора с достаточно высокой концентрацией вещества определяется энтальпийным и энтропийным факторами. Сравним переход хлорида калия в газообразное состояние и растворение его в воде:
Δ H º Δ S º Δ G º
кДж/моль Дж/моль·К кДж/моль
KCl(тв) → KCl(г) +214 +153 +169
KCl(тв) → KCl(р-р) +16,7 +75 –5,7
Энтропийный фактор в обоих случаях способствует процессу. Но при переходе в газообразное состояние процесс контролируется энтальпийным фактором – энергия затрачивается на разрушение кристаллической структуры. При обычной температуре процесс не идет. При образовании раствора происходит гидратация ионов соли. Выделяющаяся теплота в значительной мере компенсирует энергию кристаллической структуры, и процесс в этом случае контролируется энтропийным фактором.
При теоретическом рассмотрении растворов вводится понятие идеальных растворов – это такие растворы, в которых энергии взаимодействия между всеми видами частиц одинаковы: Е (А–А) = Е (В–В) = Е (А–В). При образовании идеальных растворов имеет место аддитивность объемов. Смесь воды и спирта явно не идеальный раствор, так как наблюдается уменьшение объема смеси V (Н2О) + V (С2Н5ОН) > V (смесь). К идеальным растворам наиболее близки смеси веществ, состоящих из разных изотопов.
2. Растворимость. Вещества характеризуются растворимостью.
Количественной мерой растворимости является концентрация насыщенного раствора. Растворимость твердых веществ не зависит от количества твердой фазы. У жидкостей возможна взаимная растворимость. Растворимость газа зависит от парциального давления газа над раствором.
| В |
| А |
| ↑↓ |
s = 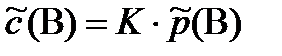 (закон Генри-Дальтона)
(закон Генри-Дальтона)
В качестве количественной характеристики растворимости газа удобен объемный коэффициент растворимости KV, численно равный объему газа, растворяющегося в 1 л жидкости при данной температуре. При этом давление не влияет на KV, но влияет на растворимость газа, так как один и тот же объем содержит количество вещества газа, пропорциональное давлению. Различают плохо растворимые газы с объемными коэффициентами растворимости много меньше единицы (KV <<1, кислород KV = 0,031 при 20ºС), умеренно растворимые газы (KV не сильно отличается от 1; СО2 KV = 0,88) и хорошо растворимые газы ((KV >>1, аммиак KV = 710).
Растворимость газов зависит от природы растворителя и, в частности, от присутствия в растворе электролитов. Знаменитый отечественный физиолог И. М. Сеченов, изучая физиологию дыхания, установил, что растворимость газов уменьшается при повышении концентрации электролита по следующему уравнению:
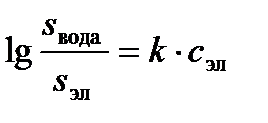
где s вода – растворимость газа в воде, s эл – растворимость в растворе электролита, с эл – концентрация электролита в данном растворе. Эта зависимость носит название закон Сеченова.
3. Коллигативные свойства растворов. Так называют свойства, которые не зависят от природы растворенного вещества, а зависят только от концентрации свободно движущихся растворенных частиц (молекул, ионов). Эти свойства называют также осмотическими.
| б |
| μ |
| Т |
| Переход тв-ж |
| Переход ж-г |
| Т з |
| Т з΄ |
| Т к |
| Т к΄ |
| Δ Т з |
| Δ Т к |
| Тв Ж Г |
| з |
| к |
Растворенное вещество, уменьшая концентрацию растворителя, дополнительно понижает его химический потенциал. Вследствие этого увеличивается интервал между температурой замерзания итемпературой кинения - Т з понижается на величину Δ Т з, а Т к повышается на величину Δ Т к.
Согласно второму закону Рауля, понижение температуры замерзания раствора по сравнению с индивидуальным растворителем пропорционально концентрации растворенного вещества. Аналогичное утверждение справедливо и для повышения температуры кипения.
Для того, чтобы представить зависимости в наиболее простой форме, введем еще один способ выражения концентрации – моляльную концентрацию.
Моляльная концентрация b численно равна количеству растворенного вещества, приходящемуся на 1 кг (1000 г) растворителя:
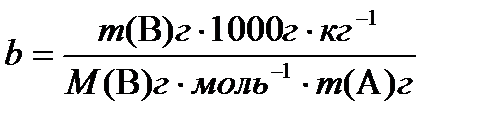
Теперь можно написать уравнения для закона Рауля:
Δ Т з = K · b; 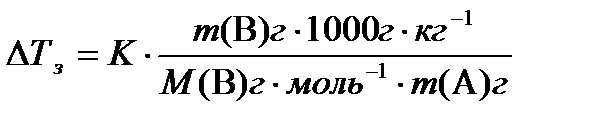
Δ Т к = E · b; 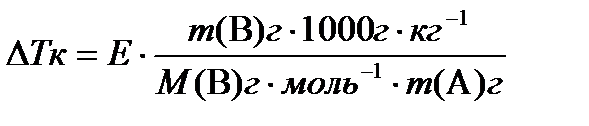
Коэффициенты K и E представляют собой константы растворителя, и называются, соответственно, криометрическая константа и эбулиометрическая константа. Так, для воды K = 1,86 К·кг·моль–1 и E = 0,52 К·кг·моль–1.
Из формул закона Рауля следует, что точное определение Δ Т з (или Δ Т к) позволяет вычислить молярную массу вещества в растворе. Значения Δ Т должны быть определены с точностью до 0,01 К. Для этого сконструированы специальные термометры.
4. Осмос. Явление осмоса постоянно наблюдается в природе. Восстановление тонуса увядших растений при поливе водой – это результат осмоса.
Осмосом называется явление самопроизвольного переноса растворителя через полупроницаемую мембрану из чистого растворителя в раствор, или из раствора с меньшей концентрацией растворенного вещества в раствор с большей концентраций.
Под свойством полупроницаемости подразумевается, что мембрана пропускает только молекулы растворителя и не пропускает более крупные молекулы растворенного вещества. Полупроницаемыми мембранами являются клеточные мембраны (внешние и внутренние) и разнообразные искусственные пленки.
В системе с мембраной, разделяющей раствор и растворитель, диффузия растворителя через мембрану идет с большей скоростью из растворителя в раствор, так как в растворе концентрация растворителя меньше. Результатом является перенос растворителя и увеличение объема раствора. От этого возрастает тургор (напряженное состояние) клеток.
| Н2О |
| С6Н12О6 |
| Н2О |
| Н2О |
| h |
| Раствор |
В перевернутую воронку, закрытую мембраной (пунктирная линия) помещается раствор (взят пример глюкозы). Воронку погружают в сосуд с водой. Вода, проникающая в раствор в результате осмоса, увеличивает объем раствора, и он начинает подниматься по трубке вверх. При достижении некоторой высоты столба подъем жидкости прекращается, устанавливается осмотическое равновесие. Гидростатическое давление столба жидкости становится равным движущей силе осмоса, которая называется осмотическим давлением π. Осмотическое давление проявляется по мере приближения системы к равновесию. Например, эритроцит, помещенный в водную среду, постепенно раздувается, мембрана натягивается. Прочность ее недостаточна, чтобы выдержать равновесное осмотическое давление, и в какой-то момент клетка лопается. Происходит гемолиз.
Явления, наблюдаемые в осмометре, наглядно подтверждают, что за счет самопроизвольного физико-химического процесса может совершаться работа. В данном случае это работа против силы тяжести. При достижении равновесия работа уже не совершается. Проведем мысленный эксперимент: добавляем в трубку осмометра воду. Столб жидкости становится выше равновесного, и далее наблюдается понижение уровня жидкости. Некоторое количество воды переходит через мембрану обратно в чистую воду. Это явление называется обратным осмосом.
Обратный осмос – это переход растворителя через мембрану из раствора в чистый растворитель под действием приложенного давления, превышающего осмотическое давление. Обратный осмос применяется для опреснения воды и концентрирования растворов.
Голандским ученым Вант-Гоффом установлен закон осмотического давления:
Осмотическое давление разбавленного раствора пропорционально его концентрации и температуре. Коэффициентом пропорциональности является универсальная газовая постоянная:
π = c·R·T
Для растворов электролитов π = i · c·R·T, где i – число ионов в форме электролита.
Осмотическое давление идеального раствора не зависит от его состава.
Осмотическое давление оказывается большой величиной, имеющей легко измеряемые значения даже для очень разбавленных растворов. Если бы в осмометре на рисунке находился раствор глюкозы с концентрацией 0,01 моль/л, то жидкость в трубке поднялась бы приблизительно на 2,5 м.
Осмотические измерения имеют также значение в медицинской диагностике и терапии. Одним из твердых правил инъекционных процедур является недопустимость введения в кровеносные сосуды дистиллированной воды. Вода смешивается с кровью, понижается осмотическое давление плазмы, и в эритроциты начинает поступать вода. Может начаться гемолиз. При патологических состояниях, сопровождающихся усиленным выделением воды, осмотическое давление плазмы крови может повышаться, что приводит к временной потере воды клетками. Это явление называется плазмолизом. Пределы изменения осмотического давления плазмы крови в норме составляют 730 – 780 кПа при физиологической температуре.
Пример. Имеется раствор глюкозы с массовой долей 0,5% (плотность 1,0001 г/л). Рассчитайте его осмотическое давление при 20ºС и температуру замерзания.
Решение. Для применения формул π = c·R·T и Δ Т з = K · b, следует вычислить молярную и моляльную концентрации, и найти в таблице криометрическую постоянную воды: 1,86 К·кг·моль–1. Для расчетов возьмем мысленно 1 л раствора; масса его составит 1,0001 кг. Очевидно, что при такой плотности, почти не отличающейся от плотности воды, молярная и моляльная концентрации будут различаться незначительно. Масса глюкозы в растворе
m (B) = 1000,1 г · 0,5%/100% = 5,0005 г
Количество вещества глюкозы (M = 180,155 г·моль–1) составляет
n = 5,0005 г/180,155 г·моль–1 = 0,02775665 моль
Теперь можно вычислить концентрации:
с = 0,02775665 моль/1 л = 0,02775665 моль/л
b = 0,02775665 моль·1000 г·кг–1/(1000,1 г – 5,0005 г) = 0,02789334 моль/кг
Уточненный расчет показал, что в данном случае разбавленного водного раствора, различие между молярной и моляльной концентрациями проявляется в третьей значащей цифре, причем оно обусловлено уменьшением содержания воды за счет присутствия растворенного вещества. Далее округлим концентрации до трех значащих цифр. Вычисляем осмотическое давление и температуру замерзания.
π = 0,0277 моль·л–1·8,31кПа·л·моль–1·К–1·(273,15 К + 20 К) = 67,5 кПа
Δ Т з = 1,86 К·кг·моль–1·0,0279 моль·кг–1 = 0,0519 К (также и ºС)
Т з = 0ºС – 0,0519ºС = –0,0519ºС
Результат расчета показывает, что осмотическое давление составляет 2/3 от атмосферы, и его можно измерить достаточно точно. Понижение температуры замерзания на 0,05 К измерить с такой же точностью значительно сложнее.
В практических исследованиях и измерениях приходится работать с растворами сложного состава (различные биологические жидкости). Такие растворы на основе осмометрии и криометрии (эбулиометрии) можно охарактеризовать суммарными значениями концентрации, которые называют осмолярность и осмоляльность.
На данном примере можно сказать, что если бы некий раствор имел π = 67,5 кПа и Δ Т з = 0,0519 К, то его осмолярность равнялась бы 0,0277 осмоль/л, и осмоляльность, соответственно 0,0279 осмоль/кг. При этом о качественном составе раствора нельзя бы сказать ничего определенного, так как π и Δ Т з – коллигативные свойства.
 2015-10-16
2015-10-16 936
936







