Слабые электролиты образуют ионы обратимо в соответствии с законом действующих масс. Равновесие распада частицы на два иона подчиняется закону разведения Оствальда (следствие ЗДМ), устанавливающего зависимость между константой диссоциации и степенью диссоциации.
Пусть в растворе устанавливается равновесие
KA K+ + A–
В состоянии равновесия имеются равные концентрации катионов и анионов, которые можно выразить через степень диссоциации и общую концентрацию. Концентрация не диссоциированного вещества равна разности между общей концентрацией и концентрацией диссоциированного вещества:
KA K+ + A–
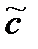 , моль/л c–α c α c α c
, моль/л c–α c α c α c
Применяем ЗДМ:
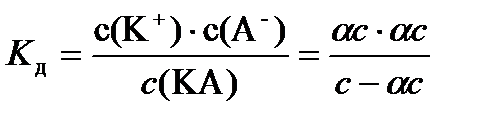 ,
,
где K д – константа диссоциации.
Окончательно получаем:
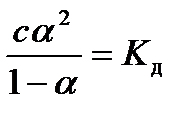
Это уравнение выражает закон разведения Оствальда. Оно применимо к разным обратимым процессам распада исходной частицы на две частицы. Чаще всего это слабые кислоты и основания. Некоторые комплексные соединения (Са2+-этилендиаминтетраацетат) также распадаются на центральный атом и один сложный лиганд. Уравнение закона Оствальда позволяет вычислять степень диссоциации при известной константе диссоциации и концентрации вещества.
При степени диссоциации α < 0,1 знаменатель принято считать равным единице, и расчеты проводят по приближенной формуле
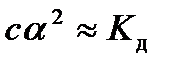 или
или 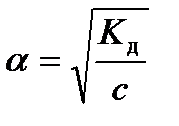
 2015-10-16
2015-10-16 2475
2475








