Комментарии для работы с рабочими тетрадями.
| 1. SiS2 + H2O →гидролиз (не ОВР) обмен катионов и анионов, образующийся гидроксид кремния (4) неустойчив и отщепляет воду с образованием кремниевой кислоты. |
| 2. Na2S3 + HCI → персульфид (Ахметов стр. 327.) |
3. Na2SO3  диспрпорционирование серы на две соли с минимальной и максимальной степенью окисления серы. диспрпорционирование серы на две соли с минимальной и максимальной степенью окисления серы. |
| 4. BaO2 + CO2 →диспропорционирование кислорода. ОВР. |
| 5. H2S2O3→тиосерная кислота содержит 2 атома серы, в разных степенях окисления, которые при разложении кислоты превращаются в свободную серу и сернистый газ. |
| 6. P + H2SO4 к →. Концентрированная серная кислота окисляет фосфор до ортофосфорной кислоты, при этом выделяется сернистый газ. |
7. H2SO4  электролизу подвергается только вода. электролизу подвергается только вода. |
| 8. Na2S2O3 + CI2 + H2O → ОВР хлор сильный окислитель, переводит тиосульфат в сульфат. |
| 9. Na2S + H2O →гидролиз по аниону |
| 10. S + NaOH →диспропорционирование серы на ближайшую положительную и ближайшую отрицательную степень окисления (сульфит и сульфид). |
| 11. BaO2 + H2SO4 →обмен (не ОВР) |
12. NH3 + O2 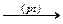 в данных условиях аммиак сгорает до оксида азота (2), это одна из стадий промышленного получения азотной кислоты из аммиака. в данных условиях аммиак сгорает до оксида азота (2), это одна из стадий промышленного получения азотной кислоты из аммиака. |
| 13. H2S + O2 → сгорание при избытке кислорода и при его недостатке идет по разному. |
| 14. Cu + H2SO4(к) →мало активные металлы восстанавливают серу до сернистого газа. |
| 15. SO2 + NO2 + H2O → ОВР азот окислитель до (+2), сера восстановитель. |
| 16. H2SeO4 + HCI → ОВР селен окислитель, хлор востановитель меняют степени окисления до ближайших соответственно. |
| 17. Cd (NO3)2 + H2S → обмен (не ОВР) реакция идет так как образуется осадок с очень низким ПР. |
| 18. CuSO4 + H2O → гидролиз по катиону. |
| 19. AICI3 + Na2S + H2O → двойной гидролиз с образованием соли сильной кислоты и сильного основания, слабый анион и катион гидролизуются полностью и необратимо. |
| 20. Na2S + KMnO4 + H2SO4 → ОВР марганец окислитель в кислой среде до (+2), сера восстановитель до молекулярной серы. |
| 21. S + H2S → реакция соединения (дисульфиды аналогичны пероксидам). |
| 22. SF4 + H2O → (не ОВР) обмен катионов и анионов, образующийся гидроксид кремния (4) неустойчив и отщепляет воду с образованием кремниевой кислоты. |
| 23. O3 + NO2 → ОВР, реакция соединения. |
| 24. Na2S + CS2 →не ОВР образующийся тиокарбонат аналогичен обычному карбонату в котором все атомы кислорода замещены атомами серы. |
| 25. H2SO4 + SO3 → олеум (реакция соединения с образованием дисерной кислоты). |
| 26. S + HNO3 (к) → ОВР сера окисляется до (+6) азот востанавливается до (+4). |
| 27. Na2SO3 + H2O → гидролиз по аниону. |
| 28. Na2S2O3 + HCI → кислотный остаток тиосерной кислоты содержит 2 атома серы, в разных степенях окисления, которые при разложении тиосерной кислоты, образующейся в реакции, превращаются в свободную серу и сернистый газ. |
| 29. AI2S3 + H2O → необратимый гидролиз соли образованной слабым основанием и слабой кислотой идет до конца. |
30. KMnO4  ОВР. Способ получения кислорода в лаборатории. При обработки ран марганцовкой. ОВР. Способ получения кислорода в лаборатории. При обработки ран марганцовкой. |
| 31. FeS2 + O2 → ОВР, обжиг пирита (3 элемента меняют степень окисления) |
| 32. K + O3 → ОВР, соединение образуется озонид. |
33. S + Na2SO3  ОВР, соединение образуется тиосульфат. ОВР, соединение образуется тиосульфат. |
| 34. BaO + O2 →ОВР соединение образуется пероксид. |
| 35. Na2Se + H2O → гидролиз по аниону. |
| 36. S + H2SO4 → ОВР |
| 37. SO2 + NaOH → обмен с образованием соли с такой же степенью окисления серы как и в исходном оксиде. |
| 38. SF4 + H2O→ гидролиз (не ОВР) обмен катионов и анионов, образующийся гидроксид серы (4) неустойчив и отщепляет воду с образованием сернистойой кислоты. |
| 39. Na2SO3 + CuSO4 + H2O → двойной гидролиз с образованием соли сильной кислоты и сильного основания, слабый анион и катион гидролизуются полностью и необратимо |
| 40. Na2S2O3 + AgCI → обмен с образованием комплексного соединения серебра с коодинационным числом 4. |
1 вариант:
Как проявляет себя сероводород в окислительно-восстановительных реакциях? Почему? Составьте электронные и молекулярные уравнения реакций взаимодействия раствора сероводорода: а) с хлором; б) с кислородом.
| Напишите уравнения реакций взаимодействия концентрированной селеновой кислоты с хлороводородом и золотом при нагревании. Определите коэффициенты электронно-ионным методом. | Селеновая кислота имеет значительно больший редокс – потенциал (1,15 В), чем серная (0,17 В), поэтому окисляет хлорид – ион до свободного хлора, а золото – до его селеновой соли. |
| При взаимодействии дихромата калия с сероводородом в кислой среде, выделился осадок, который отделили от раствора и окислили кислородом. Продукт реакции растворили в воде, при котором получили 100 г раствора с массовой долей 8,2%. Вычислите массу исходного дихромата калия и объем кислорода, необходимый для окисления выпавшего осадка. | В кислой среде дихромат калия окисляет сероводород до элементарной серы, при окислении которой получают диоксид, образующий с водой соответствующую кислоту. Расчеты необходимо производить в соответствии с составленными уравнениями. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
H2S ® SO2 ® S ® H2SO4 ® H2S ® S ® Na2S2O3 ® SO2
2 вариант:
Почему сернистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций сернистой кислоты: а) с сероводородом; б) с хлором.
Продукты окисления определяются силой окислителя. Закончите уравнения реакций: H2S + K2Cr2O7 + H2SO4  , H2S + O2(изб) , H2S + O2(изб)  , H2S + HNO3(дым) , H2S + HNO3(дым)  Определите коэффициенты электронно-ионным методом. Рассчитайте эквивалентные массы восстановителя в приведенных реакциях. Определите коэффициенты электронно-ионным методом. Рассчитайте эквивалентные массы восстановителя в приведенных реакциях. | При пропускании сероводорода через подкисленный раствор дихромата калия выпадает осадок элементарной серы. При сжигании сероводорода в избытке кислорода образуется диоксид серы. Дымящая азотная кислота окисляет сероводород максимально. |
| Объясните способность большинства р-элементов к реакциям диспропорционирования. Напишите уравнения реакции растворения серы в концентрированном растворе щелочи. Определите коэффициенты электронно-ионным методом. Рассчитайте эквивалентные массы восстановителя в реакциях. | Реакции диспропорционирования возможны для элементов, находящихся в промежуточных степенях окисления. При взаимодействии серы с горячим раствором щелочи образуются сульфит- и сульфид – ионы. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
S ® H2SO4 ® CuSO4 ® Cu(NO3)2 ® CuS.
3 вариант:
Физические и химические свойства р-элементов VI группы – простых веществ: агрегатные состояния, аллотропные модификации, изменение окислительно-восстановительной активности простых веществ в ряду: O-S-Se-Te-Po
| Объясните, почему реакция раствора гидросульфида натрия – щелочная, а раствора гидросульфита натрия – кислая. Ответ подтвердите расчетами констант гидролиза и их сравнением с соответствующими константами диссоциации. | Гидросульфид – и гидросульфит – ионы являются амфолитами. При гидролизе они образуют щелочную среду (Кг), а при диссоциации - кислую (Кд). Сравнение этих величин дает возможность определить реакцию среды их растворов. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
Cu ® CuS ® CuO ® CuSO4 ® Na2SO4 ® NaНSO4 ® BaSO4® BaS® SO2® S ® H2SO4
4 вариант:
Закончите уравнения реакций: Na2SO3 + CI2 + H2O  , H2S + H2SO4 , H2S + H2SO4  Объясните окислительно-восстановительную двойственность сульфит-иона. Определите коэффициенты электронно-ионным методом. Рассчитайте эквивалентные массы восстановителя в реакциях. Объясните окислительно-восстановительную двойственность сульфит-иона. Определите коэффициенты электронно-ионным методом. Рассчитайте эквивалентные массы восстановителя в реакциях. | При взаимодействии с окислителями сульфит – ион переходит в сульфат – ион, с восстановителями – в элементарную серу. |
Указать лабораторные и промышленные способы получения кислорода, перечислить важнейшие области его практического применения.
Закончите уравнения реакции и объясните возможность использования при Na2S2O3 при лечении чесотки. Na2S2O3+ HCI  | Продукты разложения тиосерной кислоты оказывают пагубное влияние на чесоточного клеща. |
| Рассчитайте массу тиосульфата натрия, необходимую для взаимодействия с 4,48 л хлора (н.у). | Необходимо составить уравнение, подобрать коэффициенты, в соответствии с которыми произвести расчеты. При этом следует учесть, что реально тиосульфата натрия необходимо взять больше расчетного количества, так как он применятся в виде пентагидрата. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
FeS2 ® SO2 ® S ® H2S ® Na2S ® Na2SO4 ® NaCl
5 вариант:
| Составьте уравнение реакции разложения пероксида водорода. Коэффициенты в уравнении реакции определите электронно-ионным методом. Напишите уравнение диссоциации пероксида водорода и его графическую формулу. | Реакция разложения пероксида водорода – реакция диспропорционирования. В результате реакции выделяется кислород. |
| Испытание на подлинность пероксида водорода проводят следующим образом: к раствору препарата добавляют разбавленную H2SO4, эфир и раствор дихромата калия, затем смесь перемешивают. Эфирный слой окрашивается в синий цвет. Напишите уравнение реакции, эмпирическую и графическую формулу соединения, обуславливающего синий цвет. Укажите роль эфира. | При обработке кислого раствора дихромата калия пероксидом водорода образуется пироксосоединение хрома синего цвета, устойчивое в среде эфира. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
Na ® H2S ® (NH4)2S ® H2S ® Na2S ® Na2SO4 ® NaCl
6 вариант:
Составьте уравнения реакций, описывающие следующие превращения: H2S  S S  SO2 SO2  H2SO4 H2SO4  H2S H2S  SO2 Определите коэффициенты электронно-ионным методом. Рассчитайте эквивалентные массы восстановителя в реакциях. SO2 Определите коэффициенты электронно-ионным методом. Рассчитайте эквивалентные массы восстановителя в реакциях. | Серу из водорода можно получить при взаимодействии H2S с соответствующими окислителями. Далее при сжигании серы получают ее диоксид, который при окислении и растворении в воде образует серную кислоту. |
Получите кислород по реакциям при нагревании: KMnO4  NaNO3 NaNO3  Zn(NO3)2 Zn(NO3)2  AgNO3 →. Определите коэффициенты в уравнениях реакций методом электронного баланса. AgNO3 →. Определите коэффициенты в уравнениях реакций методом электронного баланса. | При термическом разложении перманганата калия происходит реакция диспропорционирования. При разложении нитратов металлов, стоящих в электрохимическом ряду напряжений левее магния, образуются нитраты и кислород, от магния до меди – оксиды металлов, оксид азота (IV) и кислород, для металлов, стоящих после меди – свободные металлы, оксид азота (IV) и кислород. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
FeS2 ® SO2 ® S ® H2S ® Na2S ® Na2SO4 ® NaCl
7 вариант:
| Напишите уравнения реакций взаимодействия тиосульфата натрия с избытком хлорной воды и иодом. Определите коэффициенты электронно-ионным методом. Рассчитайте эквивалентные массы восстановителя в реакциях. | Хлорная вода – сильный окислитель. Избыток сильного реактива переводит тисульфат – ион в сульфат – ион. Окислительные свойства иода слабее, поэтому в результате реакции обр – тся тетратионат- ион. |
| Напишите уравнение реакции взаимодействия H2O2: а) с KI б) с KMnO4 в кислой среде. Определите коэффициенты электронно-ионным методом. В каждом уравнении реакции укажите окислитель и восстановитель. | Пероксид водорода содержит кислород в промежуточной степени окисления(-1), следовательно, при взаимодействии с восстановителями(KI) он проявляет окислительные свойства. с окислителями (KMnO4) – выступает в роли восстановителя. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
CuSO4 ® FeSO4 ® Fe ® FeS ® H2S ® SO2® Na2SO3 ® NaCl
8 вариант:
| Приведите примеры реакций, подтверждающих окислительно-восстановительную двойственность сульфит-ионов. Определите коэффициенты электронно-ионным методом и рассчитайте эквивалентную массу окислителя. | Легкость перехода сульфит – иона в сульфат – ион обусловливает его сильные восстановительные свойства. При взаимодействии с более сильными восстановителями (H2S) сульфит – ион ведет себя как окислитель и восстанавливается до свободной серы. |
| Рассчитайте объем 0,1 М раствора пероксида водорода, необходимый для окисления в кислой среде 100 мл 0,1 М раствора сульфата железа (II). | Для расчета объема раствора пероксида водорода необходимо составить уравнение его взаимодействия с сульфатом железа (II) и определить коэффициенты электронно-ионным методом. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
Cu ® CuS ® CuO ® CuSO4 ® Na2SO4 ® NaНSO4 ® BaSO4® BaS® SO2® S ® H2SO4
9 вариант:
| Напишите уравнения реакций качественного обнаружения сульфид-, сульфит-, тиосульфат-ионов и ионном и молекулярном виде | Сульфид – ион можно обнаружить с помощью катионов тяжелых металлов. Сульфит – ион в кислой среде переходит в диоксид серы, который обесцвечивает растворы перманганата калия и йода. Сульфат – ион обнаруживают с помощью катиона бария. Тиосульфат – ион в кислой среде образует тиосерную кислоту, которая разлагается с образованием элементарной серы. |
Закончите уравнения реакций. Определите коэффициенты электронно-ионным методом. Укажите окислитель и восстановитель. Na[Cr(OH)6] + H2O2  Na2CrO4 +..., H2O2 + [Ag(NH3)2]OH Na2CrO4 +..., H2O2 + [Ag(NH3)2]OH  … + Ag + … … + Ag + … | В реакциях с гексагидроксохроматом(III) натрия и ортомышьяковистой кислотой пероксид водорода является окислителем, при взаимодействии с гидроксидом диамминсеребра (I)перксид водорода проявляет восстановительные свойства. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
ZnS ® SO2 ® S ® H2SO4.
10 вариант:
| Напишите уравнения реакций взаимодействия пероксида водорода: а) с пермангонатом калия в кислой среде б) с йодидом калия в кислой среде. Определите коэффициенты электронно-ионным методом. Укажите окислитель и восстановитель. | Пероксид водорода содержит кислород в промежуточной степени окисления, поэтому в реакциях с окислителями (Ag2О) он проявляет восстановительные свойства, при взаимодействии с восстановителями (KI) – окислительные. |
В зависимости от силы восстановителя, концентрированная серная кислота по-разному реагирует с галогенид-ионами. Закончите уравнения реакций и определите коэффициенты электронно-ионным методом: NaCI (T) + H2SO4(к)  , NaBr(T) + H2SO4(к) , NaBr(T) + H2SO4(к)  , NaJ(T) + H2SO4(к) , NaJ(T) + H2SO4(к)  Сравните восстановительные свойства галогенид-ионов. Сравните восстановительные свойства галогенид-ионов. | Реакция между хлоридом натрия и серной кислой используется в лабораторной практике для получения хлороводорода. Бромид – ион восстанавливает серную кислоту – до оксида серы(IV), йодид – ион – до сероводорода. |
| При пропускании 10 л сероводорода (н.у.) через 2 кг раствора сернистой кислоты образовалось 19,2 г серы. Определите массовую долю сернистой кислоты. | Расчеты должны быть произведены в соответствии с уравнением реакции взаимодействии сероводорода и серной кислоты. |
ТЕМА 7:
 2015-10-16
2015-10-16 1251
1251
