Комментарии для работы с рабочими тетрадями.
| 1. Mg3N2 + H2O → реакция обмена между разно заряженными атомами и ионами. |
| 2. N2H4 + O2 →азот содержащие вещества сгорают до молекулярного азота. Замещенные гидразины используется как ракетное топливо. |
| 3. NH2OH + K2Cr2O7 + HCI → в водной среде окислитель хром +6 в кислой среде до +3, азот окисляется до молекулярного азота. В обезвоженной среде образуется молекулярных хлор, который направляет реакцию по другому. |
| 4. HNO3 (к) + Cu2S → ОВР, 3 элемента меняют степень окисления: сера до +4, медь до +2, азот до +4. |
| 5. Au + HNO3 + HCI → растворение золота в царской водке – золото до +3, азот до +2. образуется не просто хлорид золота (3), а золото содержащая комплексная кислота, в которой координационное число золота (4). |
6. NaNO3  ОВР. ОВР. |
| 7. H3PO2 + NaOH→фосфорноватистая кислота одноосновная. |
8. H3PO4  метафосфорная и пирофосфорная кислоты содержат меньше воды чем ортофосфорная. метафосфорная и пирофосфорная кислоты содержат меньше воды чем ортофосфорная. |
| 9. Ca3(PO4)2 + H3PO4 →соединение, при избытке кислоты до дигидрофосфатов, так как они наиболее устойчивы. |
10. NaNO2 + KMnO4 + H2SO4  азот окисляется до +4 или +5, марганец восстанавливается в кислой среде до +2. азот окисляется до +4 или +5, марганец восстанавливается в кислой среде до +2. |
| 11. NH3 + O2 → азот содержащие вещества сгорают до молекулярного азота. В отсутствии катализатора. |
| 12. N2H4 + HNO2 → ОВР. Сложный механизм многоступенчатой реакции. |
| 13. N2H4 + Cl2 → ОВР. Сложный механизм многоступенчатой реакции. При сгорании в атмосфере хлора образуется азот молекулярный и хлороводород. |
| 14. N2O5 + Sr(OH)2 →реакция нейтрализации (обмена) образуется соль азот содержащей кислоты с такой же степенью окисления. |
| 15. KNO2 + PbO2 + H2SO4 → ОВР. PbO2 восстанавливается до Pb2+, азот повышает свою степень окисления азота. |
16. AgNO3  ОВР. ОВР. |
| 17. H3PO3 + Ba(OH)2 → фосфористая кислота 2-х основная. |
| 18. Ca3(PO4)2 + C + SiO2 → ОВР – реакция получения молекулярного фосфора. |
| 19. AIP + HCI → реагция обмена между катионами и анионами. |
| 20. NH4CI + Na2CO3 + H2O → двойной гидролиз с образованием соли сильной кислоты и сильного основания, слабый анион и катион гидролизуются полностью и необратимо. |
21. NH3 + O2 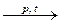 если реакция в присутствии катализатора то азот сгорает до +2. если реакция в присутствии катализатора то азот сгорает до +2. |
22. NH3 + CO 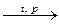 не ОВР – реакция получения формамида (амид муравьиной кислоты). не ОВР – реакция получения формамида (амид муравьиной кислоты). |
| 23. N2H4 + KMnO4 + H2SO4 → азот окисляется до с.о. (0) марганец восстанавливается в кислой среде до +2. |
| 24. NH2OH + O2→ азот содержащие вещества сгорают до молекулярного азота. |
| 25. HNO3 + P2O5 →оксид фосфора (V) сильное водо отнимающее средство, отнимая воду от азотной кислоты способствует её разложению на высший оксид азота. |
| 26. P + HNO3(к)→ ОВР. Фосфор восстановитель, окисляется до с.о. +5, азот окислитель до +2. |
27. Pb(NO3)2  ОВР. ОВР. |
| 28. P2O3 + NaOH →образуется соль фосфористой кислоты, фосфористая кислота 2-х основная.. |
29. H3PO2  ОВР. ОВР. |
| 30. As2S3 + O2 → обжиг до оксидов. |
| 31. NH3 + Na → Замещение натрием водорода до амида. |
32. NH3 + CO2 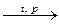 не ОВР – реакция получения мочевины (карбамида) не ОВР – реакция получения мочевины (карбамида) |
| 33. N2H4 + K2Cr2O7 + H2SO4 → азот окисляется до (0) хром восстанавливается в кислой среде до +3. |
| 34. NH2OH + HCI → Соединение, не ОВР. Образуется гидрохлорид гидроксиламина. Используется в органическом синтезе (капролактама, оксимов, аминокислот с удаленной аминогруппой). |
| 35. NaNO2 + KJ + H2SO4 → йод окисляется до (0) азот восстанавливается в кислой среде до +2. |
| 36. PH3 + HJ → Соединение, не ОВР. Ион водорода в HJ очень активен. |
| 37. P + HNO3 (р) →ОВР Рдо Р+5 |
38. H3PO3  |
| 39. Ca3(PO4)2 + H2SO4 → Обмен. Более сильная кислота вытесняет более слабую из её соли образуется осадок. |
| 40. Na3PO4 + H2O →гидролиз по аниону. |
1 вариант:
На основании электронных уравнений составьте уравнение реакции фосфора с азотной кислотой, учитывая, что фосфор приобретает высшую степень окисления, а азот + 4.
Составьте уравнения реакций, описывающие следующие превращения: Bi  Bi(NO3)3 Bi(NO3)3  NaBiO3 NaBiO3  Bi(NO3)3 Bi(NO3)3  BiONO3 Для окислительно-восстановительных реакций подберите коэффициенты электронно-ионным методом. BiONO3 Для окислительно-восстановительных реакций подберите коэффициенты электронно-ионным методом. | Нитрат висмута (III) получают при взаимодействии висмута с разбавленной азотной кислотой, в концентрированной HNO3 висмут пассивируется. Окисление соединений висмута (III) до висмута (V)возможно с помощью очень сильных окислителей(CI2) в сильнощелочной среде. Висмутат натрия является сильным окислителем, способным перевести Mn (II) в Mn (VII). Образующиеся при этом соли висмута (III) гидролизуются с образованием оксосолей. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
NH4NO3 ®NH3 ® NH4NO2 ® N2 ® NH3 ® NH4Cl ® BaCl2
2 вариант:
Фосфор. Структура аллотропных модификаций. Промышленное получение фосфора.
| Напишите уравнения реакций мышьяка с хлором и концентрированной азотной кислотой. Определите коэффициенты электронно-ионным методом. Назовите продукты взаимодействия. | Хлор окисляет мышьяк при нагревании до хлорида мышьяка (V), концентрированная азотная кислота – до ортомышьяковой кислоты. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
Al(NO3)3 ® NO2 ® HNO3 ® NH4NO3 ® NH3 ®
(NH4)2SO4 ® K2SO4
3 вариант:
В каком газообразном соединении азот проявляет свою низшую степень окисления? Напишите уравнения реакций получения этого соединения. Какие отрицательные степени окисления бывают у азота, приведите разнообразные примеры таких соединений и назовите их?
| Смесь, состоящая, из одного объема азотной и 3-4 объемов концентрированной хлороводородной кислоты называется, «царской водкой», которая растворяет золото и платину. Напишите уравнения соответствующих реакций: а) с образованием простых солей; б) с образованием комплексных соединений золота и платины. Определите коэффициенты электронно-ионным методом. | При растворении золота в «царской водке» образуется хлорид золота (III) или тетрохлороаурат (III) водорода. Продуктами растворения платины в данной смеси кислот являются хлорид платины(IV) или гексахлороплатинат(IV) водорода. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
As® H3AsO4®NаAsO4® AsH3® KAsO2®As 2O3 ®
AsH3® As 2O3
4 вариант:
Закончите уравнения следующих реакций:
а) взаимодействии хлорида аммония с гидроксидом кальция; б) разложением нитрида магния водой.
Составьте уравнения реакций, описывающие следующие превращения: P4  Na[PO2H2] Na[PO2H2]  H3PO4 H3PO4  Ca(PO4)2 Ca(PO4)2  P4 Для окислительно-восстановительных реакций подберите коэффициенты электронно-ионным методом. P4 Для окислительно-восстановительных реакций подберите коэффициенты электронно-ионным методом. | Белый фосфор получают восстановлением фосфата кальция углем в присутствии песка. Гипофосфит получается при диспропорционировании фосфора в щелочной среде. Гипофосфит является сильным восстановителем, при взаимодействии с такими катионами металлов как Аg2+, Hg2+ он окисляется до ортофосфорной кислоты, при нейтрализации которой получают фосфаты. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
Zn(NO3)2 ® NO2 ® HNO3 ® KNO3 ® KNO2.
5 вариант:
| Реакция взаимодействия фосфора с концентрированной азотной кислотой протекает таким образом, что фосфор окисляется максимально. В щелочной среде фосфор дипропорционирует. Напишите уравнения реакций, определите коэффициенты электронно-ионным методом. Рассчитайте эквивалентные массы восстановителя в реакций. | Концентрированная азотная кислота окисляет фосфор до ортофосфорной кислоты. При диспропорционировании фосфора в щелочной среде образуются фосфин и гипофосфит. |
Азотиста кислота проявляет как окислительные так и восстановительные свойства. Закончите уравнения реакций: KI + HNO2 + H2SO4  , HNO2 + KMnO4 + H2SO4 , HNO2 + KMnO4 + H2SO4  . Определите коэффициенты электронно-ионным методом и определите окислительно-восстановительную двойственность HNO2. . Определите коэффициенты электронно-ионным методом и определите окислительно-восстановительную двойственность HNO2. | Азотная кислота восстанавливается до ближайшей устойчивой степени окисления, при окислении она переходит в нитрат. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
Mg(NO3)2 ® O2 ® P2O5 ® Na3PO4® Ca3(PO4)2 ®P ® H3PO4 ® K3PO4 ® H3PO4
6 вариант:
| 75 мл раствора азотной кислоты полностью нейтрализуются 108 мл 1 н раствора NaOH. Рассчитайте нормальную концентрацию азотной кислоты в растворе. Сколько граммов ее содержится в 1 л этого раствора? | Объемы растворов реагирующих веществ обратно пропорциональны их нормальным концентрациям. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
N2 ® NO ® NO2 ® HNO3 ® N2 ® NH3 ® NH4NO2 ®
N2 ® Li3N ® NH3 ® N2.
Составьте уравнения реакций, описывающие следующие превращения: As2O3  AsH3 AsH3  As As  As2O3 As2O3  KAsO3 Для окислительно-восстановительных реакций определите коэффициенты электронно-ионным методом. KAsO3 Для окислительно-восстановительных реакций определите коэффициенты электронно-ионным методом. | Оксид мышьяка(III) получают окислением простого вещества при нагревании. Для превращения оксида в фосфин необходим сильный восстановитель – атомарный водород, образующийся при растворении цинка в кислоте. Для получения оксида фосфин следует окислить, и далее при сплавлении со щелочью перевести в метаарсенит. |
7 вариант:
| При термическом разложении 200 г образца нитрата калия выделилось 11,2 л кислорода (н.у). Определите массовую долю КNО2 в образце. | При термическом разложении нитратов щелочных металлов образуются нитриты. |
| К растворам, содержащим SbCI3 и BiCI3 добавили избыток КОН. Напишите ионные и молекулярные уравнения протекающих реакций. Какое вещество находится в осадке? | В щелочной среде SbCI3 и BiCI3 переходят в гидроксиды. Гидроксид сурьмы(III) обладает амфотерными свойствами, гидроксид висмута(III) – основными. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
NH4NO2 ® N2 ® NH3 ® NO® NO2 ® HNO3 ® NH4NO3 ® KNO3 ®Вa(NO3)2 ® HNO3 ® NH4NO3® H2O.
8 вариант:
Для качественного обнаружения ионов аммония применяют реакцию: NH4CI + Ca(OH)2  Закончите уравнения реакций. Как обнаружить наличие аммиака? Закончите уравнения реакций. Как обнаружить наличие аммиака? | Нагревание солей аммония со щелочами – лабораторный способ получения аммиака, обнаружить который можно по соответствующему изменению цвета индикатора, запаху. |
31. Закончите уравнения реакций полученияAsН3: Zn + AsCI5 + H2SO4  , Zn + NaAsO3 + HCI , Zn + NaAsO3 + HCI  Определите коэффициенты электронно-ионным методом. Вычислите эквивалентную массу окислителя в каждой реакции. Определите коэффициенты электронно-ионным методом. Вычислите эквивалентную массу окислителя в каждой реакции. | 31. При взаимодействии кислоты с цинком образуется атомарный водород – активный восстановитель, который восстанавливает соединения мышьяка в любой степени окисления до арсина. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
PH3 ® P2O3 ®H2[PHO3] ® H3PO4 ® K2HPO4
9 вариант:
| Укажите степень окисления и валентность азота в молекуле HNO3. Приведите графическую формулу нитрата аммония. | Степень окисления азота в азотной кислоте максимальна и соответствует номеру группы периодической системы, в которой находится элемент. Валентность азота в азотной кислоте также максимальна, она совпадает с количеством орбиталей в послед – м энергетическом уровне. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
Bi(NO3)3 ® Bi® Mg3Bi2® BiH3
Составьте уравнения реакций, описывающие следующие превращения: N2  HN3 HN3  NO NO  NO2 NO2  HNO3 HNO3  NH4NO3 Для окислительно-восстановительных реакций определите коэффициенты электронно-ионным методом или методом электронного баланса для газовых систем. NH4NO3 Для окислительно-восстановительных реакций определите коэффициенты электронно-ионным методом или методом электронного баланса для газовых систем. | Аммиак получают прямым синтезом из простых веществ при повышенном давлении, температуре и в присутствии катализатора. Оксиды азота и азотную кислоту следует получить при последовательном окислении аммиака. Нитрат аммония образуется в реакции нейтрализации, а также при взаимодействии очень разбавленной кислоты с активным металлом. |
10 вариант:
В окислительно-восстановительных реакциях висмут натрия применяют в качестве окислителя. Закончите уравнения реакции: MnSO4 + Na BiO3 + HNO3  HMnO4 +... +... Определите коэффициенты электронно-ионным методом и рассчитайте эквивалентную массу окислителя. HMnO4 +... +... Определите коэффициенты электронно-ионным методом и рассчитайте эквивалентную массу окислителя. | Висмутат натрия, обладающий сильными окислительными свойствами, переводит Mn2+ в перманганат – ион, восстанавливаясь при этом до Bi3+. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
As ® As 2O3 ® H[AsCl4] ® AsH3 ® As
Окислительные свойства азотной кислоты зависят от концентрации. Закончите уравнения реакций: Cu + HNO3(КОНЦ)  , Cu + HNO3 p. , Cu + HNO3 p.  , Zn + HNO3 (оч.разб.) , Zn + HNO3 (оч.разб.)  Определите коэффициенты электронно-ионным методом. Вычислите эквивалентную массу окислителя в каждой реакции. Определите коэффициенты электронно-ионным методом. Вычислите эквивалентную массу окислителя в каждой реакции. | Восстановление азотной кислоты происходит тем полнее, чем меньше ее концентрация и чем активнее металл, с которым она взаимодействует. |
11 вариант:
| Исходя из положения азота, фосфора, мышьяка, сурьмы и висмута в периодической системе, составьте формулы их оксидов и гидроксидов, отвечающей высшей степени окисления. Охарактеризуйте химический характер этих соединений при переходе от азота к висмуту. | Данные элементы расположены в VА группе периодической системы, следовательно, их высшая степень окисления +5. Химический характер оксидов и гидроксидов соответствующих этой степени окисления, закономерно изменяется от кислотного до основного. |
Соли азотной кислоты(нитраты) при нагревании разлагаются с выделением кислорода. Закончите уравнения реакций и определите тип окислительно-восстановительных реакций: KNO3  , AgNO3 , AgNO3  , Cu(NO3)2 , Cu(NO3)2  . Определите коэффициенты методом электронного баланса. . Определите коэффициенты методом электронного баланса. | При термическом разложении нитратов щелочных металлов образуются нитраты, нитраты тяжелых металлов разлагаются с образованием оксидов, нитраты благородных металлов, оксиды которых термически неустойчивы разлагаются с образованием свободных металлов. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
P ® Ca3P2 ® PH3 ® P2O5 ® Ca3(PO4)2 ® H3PO4 ® Na3PO4 ® Ca3(PO4)2 ® P ® P2O5 ® H3PO4
 2015-10-16
2015-10-16 1413
1413
