Комментарии для работы с рабочими тетрадями.
1. B2H6  разложение до простых веществ разложение до простых веществ |
2. B2H6 + H2O  обмен между положительно и отрицательно заряженными частицами. При встрече гидрид аниона в боране с гидрид катионом в воде образуется молекулярный водород. обмен между положительно и отрицательно заряженными частицами. При встрече гидрид аниона в боране с гидрид катионом в воде образуется молекулярный водород. |
3. H3BO3 + NaOH p  обмен образуются тетраборат (возможно метаборат) и вода, так как соли ортобораты не устойчивы. обмен образуются тетраборат (возможно метаборат) и вода, так как соли ортобораты не устойчивы. |
4. BCI3 + AICI3  комплексообразование, у алиминия к.ч. 6. комплексообразование, у алиминия к.ч. 6. |
5. H3BO3 + H2O  борная кислота одноосновная за счет перехода её под лействием воды в комплексное соединение тетрагидроксоборат водорода. борная кислота одноосновная за счет перехода её под лействием воды в комплексное соединение тетрагидроксоборат водорода. |
6. Na2B4O7 + HCI + H2O  реакция обмена. Образующаяся слабая неустойчивая тетраборная кислота сразу превращается в устойчивую ортоборную. реакция обмена. Образующаяся слабая неустойчивая тетраборная кислота сразу превращается в устойчивую ортоборную. |
7. AI2O3 + Na2CO3  обмен при сплавлении. образующийся газ покидает реакционную систему в которой также образуется метаалюминат. обмен при сплавлении. образующийся газ покидает реакционную систему в которой также образуется метаалюминат. |
8. AI(OH)3 + CH3COOH  обмен. обычная реакция нейтрализации. обмен. обычная реакция нейтрализации. |
9. TI2O + H2O  не ОВР. соединение. не ОВР. соединение. |
10. AI2O3  ОВР. ОВР. |
11. B2H6 + O2  ОВР сгорает до 2 оксидов. ОВР сгорает до 2 оксидов. |
12. B2H6 + HCI  обмен между положительно и отрицательно заряженными частицами. При встрече гидрид аниона в боране с гидрид катионом в воде образуется молекулярный водород. обмен между положительно и отрицательно заряженными частицами. При встрече гидрид аниона в боране с гидрид катионом в воде образуется молекулярный водород. |
13. H3BO3 + Na2CO3  обмен образуются тетраборат (возможно метаборат) и вода, так как соли ортобораты не устойчивы, образующийся газ покидает реакционную систему. обмен образуются тетраборат (возможно метаборат) и вода, так как соли ортобораты не устойчивы, образующийся газ покидает реакционную систему. |
14. B2O3 + Na2O  соединение (не ОВР) может образоваться любая из устойчивых солей борных кислот, в зависимости от мольных соотношений исходных веществ. соединение (не ОВР) может образоваться любая из устойчивых солей борных кислот, в зависимости от мольных соотношений исходных веществ. |
15. AI + Fe3O4  ОВР алюмотермия. Эффективный зажигательный состав температура реакции около 30000С. ОВР алюмотермия. Эффективный зажигательный состав температура реакции около 30000С. |
16. AI2(SO4)3 + KOH  Обмен идущий в две стадии. вторая стадия протекает при избытке щелочи с образованием комплексного соединения алюминия (коорд. число 4или 6). Обмен идущий в две стадии. вторая стадия протекает при избытке щелочи с образованием комплексного соединения алюминия (коорд. число 4или 6). |
17. AIF3 + NaF  соединение с образованием комплексной соли аналогичной природному криолиту. соединение с образованием комплексной соли аналогичной природному криолиту. |
18. Ga + NaOH + H2O  ОВР Ga восстановитель, водород-катион окислитель. Газ покидает реакционную систему в которой также образуется соль анион которой содержит Ga+3. ОВР Ga восстановитель, водород-катион окислитель. Газ покидает реакционную систему в которой также образуется соль анион которой содержит Ga+3. |
19. AIH3 + LiH  соединение с образованием комплексного соединения алюминия (коорд. число 4). Образуемое вещество восстановитель, широко применяемый при органическом синтезе, имеющий селективное действие (не восстанавливает двойные связи). соединение с образованием комплексного соединения алюминия (коорд. число 4). Образуемое вещество восстановитель, широко применяемый при органическом синтезе, имеющий селективное действие (не восстанавливает двойные связи). |
20. AICI3 + Na2CO3 + H2O  двойной гидролиз с образованием соли сильной кислоты и сильного основания, слабый анион и катион гидролизуются полностью и необратимо. двойной гидролиз с образованием соли сильной кислоты и сильного основания, слабый анион и катион гидролизуются полностью и необратимо. |
21. BCI3 + H2O  гидролиз по катиону. гидролиз по катиону. |
22. B + H2SO4  ОВР бор превращается в устойчивую кислоту, сера восстанавливается до +4. ОВР бор превращается в устойчивую кислоту, сера восстанавливается до +4. |
23. H3BO3 + NaOH  обмен образуются тетраборат (возможно метаборат) и вода, так как соли ортобораты не устойчивы. обмен образуются тетраборат (возможно метаборат) и вода, так как соли ортобораты не устойчивы. |
24. BF3 + NaF  соединение с образованием комплексного соединения бора (корд. число 4). соединение с образованием комплексного соединения бора (корд. число 4). |
25. AI2(SO4)3 + H2O  гидролиз по катиону. гидролиз по катиону. |
26. AI + NaOH + H2O  ОВР AI0восстановитель H+ окислитель. Комплексообразование у AI3+ координационное число 6 и 4. ОВР AI0восстановитель H+ окислитель. Комплексообразование у AI3+ координационное число 6 и 4. |
27. AI2O3 + HF  обмен. обмен. |
28. AI + HNO3 (p)  ОВР AI0восстановитель N+5 окислитель. ОВР AI0восстановитель N+5 окислитель. |
29. AI + C  соединение. С0 восстанавливается до С+4. соединение. С0 восстанавливается до С+4. |
30. AI(Hg) + H2O  амальгамированный алюминий (лишенный оксидной пленки) растворяется в воде с образованием гидроксида. ОВР. Амальгамированный алюминий широко применяется в органическом синтезе как восстановитель. амальгамированный алюминий (лишенный оксидной пленки) растворяется в воде с образованием гидроксида. ОВР. Амальгамированный алюминий широко применяется в органическом синтезе как восстановитель. |
31. BCI3 + NH3  связь между N-3 и В+3 образуется по донорно акцепторному менханизму. не ОВР – соединение. связь между N-3 и В+3 образуется по донорно акцепторному менханизму. не ОВР – соединение. |
32. Bаморф + KOH + H2O  В восстановитель, водород-катион окислитель. В восстановитель, водород-катион окислитель. |
33. Na2B4O7 + H2O  гидролиз по аниону. гидролиз по аниону. |
34. Mg3B2 + HCI  обмен между положительно и отрицательно заряженными частицами. при встрече бор аниона с гидрид катионом образуется боран. обмен между положительно и отрицательно заряженными частицами. при встрече бор аниона с гидрид катионом образуется боран. |
35. AI4C3 + H2O  обмен между положительно и отрицательно заряженными частицами. При встрече карбид аниона с гидрид катионом образуется метан. обмен между положительно и отрицательно заряженными частицами. При встрече карбид аниона с гидрид катионом образуется метан. |
36. AICI3 + NaOH изб  Обмен идущий в две стадии. вторая стадия протекает при избытке щелочи с образованием комплексного соединения алюминия (корд. число 4или 6). Обмен идущий в две стадии. вторая стадия протекает при избытке щелочи с образованием комплексного соединения алюминия (корд. число 4или 6). |
37. AI + K2Cr2O7 + HCI  ОВР. хром - окислитель, восстанавливается до с.о. +3, алюминий - восстановитель. ОВР. хром - окислитель, восстанавливается до с.о. +3, алюминий - восстановитель. |
38. AI2O3 + NaOH  не ОВР. образуется метаалюминат. не ОВР. образуется метаалюминат. |
39. AI + NH3  замещение. нитрид алюминия содержит тройную связь. замещение. нитрид алюминия содержит тройную связь. |
40. Na2B4O7 + Fe2O3  обмен (не ОВР) образуются метабораты натрия и железа, без изменения степеней окисления. обмен (не ОВР) образуются метабораты натрия и железа, без изменения степеней окисления. |
1 вариант:
Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений:
А1 ® Al2(SO4)3 ® Na[A1(OH)4] ® Al(NO3)3.
| При высокой температуре бор соединяется со многими металлами и неметаллами. Напишите уравнения реакций взаимодействия боа с магнием, азотом, кислородом, серой. Назовите продукты по систематической номенклатуре. | В обычных условиях бор всегда инертен, при нагревании (400- 7000С) окисляется кислородом, серой и даже азотом (12000С). С активными металлами (Мg) бор образует бориды. |
B2H6 + O2  ОВР, диборан сгорает до 2 оксидов.
ОВР, диборан сгорает до 2 оксидов.
AI + Fe3O4  ОВР, алюмотермия.
ОВР, алюмотермия.
2 вариант:
Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений:
а) Cr2O3 + 2Al =;
б) Аl + NaOH + Н2О =;
в) Аl(NO3)3 + K2CO3 + H2O =.
Составьте уравнение реакций, описывающие следующие превращения: B  H3BO3 H3BO3  Na2B4O7 Na2B4O7  H3BO3 H3BO3  B(OC2H5)3. Для окислительно-восстановительных реакций определите коэффициенты электронно-ионным методом. B(OC2H5)3. Для окислительно-восстановительных реакций определите коэффициенты электронно-ионным методом. | Концентрированные серная и азотные кислоты окисляют бор до ортоборной кислоты. При нейтрализации ортоборной кислоты избытком щелочи образуется тетраборат, который под действием кислот опять переходит в ортоборную кислоту. Борноэтиловый эфир образуется при взаимодействии ортоборной кислоты с этиловым спиртом в присутствии водоотнимающего средства – серной кислоты. |
Ga + NaOH + H2O  ОВР, Ga восстановитель, водород-катион окислитель. газ покидает реакционную систему, в которой также образуется соль, анион которой содержит Ga+3.
ОВР, Ga восстановитель, водород-катион окислитель. газ покидает реакционную систему, в которой также образуется соль, анион которой содержит Ga+3.
3 вариант:
Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений:
Al ® Al4C3 ® Al(OH)3 ® Al2O3 ® Al ® Al2S3 ® Al2O3 ® Al2(SO4)3 ® AlCl3 ® Al(NO3)3 ® O2.
| Соли алюминия подвергаются гидролизу. Напишите ионные и молекулярные уравнения гидролиза: Al2(SO4)3 и Al(CН3CОО)3. Укажите реакцию среды в каждом растворе. | Сульфат алюминия – соль слабого основания и сильной кислоты, гидролизуются по катиону с образованием основной соли. гидролиз ацетата алюминия происходит и по катиону и по аниону с образованием малорастворимого основания. |
B + H2SO4  ОВР, бор превращается в устойчивую кислоту, сера восстанавливается до с.о. +4.
ОВР, бор превращается в устойчивую кислоту, сера восстанавливается до с.о. +4.
4 вариант:
Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений:
Al4C3 ® Al(OH)3 ® Al(NO3)3 ® Al2O3 ® Al ® Al2(SO4)3 ® AlCl3 ®Al(NO3)3 ® Al(OH)3 ® Al2O3 ® KAlO2.
AI + NaOH + H2O  ОВР, AI0 - восстановитель, H+ окислитель. Комплексообразование, у AI3+ координационное число 6 и 4.
ОВР, AI0 - восстановитель, H+ окислитель. Комплексообразование, у AI3+ координационное число 6 и 4.
AI + HNO3 (p)  ОВР, AI0 - восстановитель N+5 -окислитель.
ОВР, AI0 - восстановитель N+5 -окислитель.
AI(Hg) + H2O  амальгамированный алюминий (лишенный оксидной пленки) растворяется в воде с образованием гидроксида. ОВР.
амальгамированный алюминий (лишенный оксидной пленки) растворяется в воде с образованием гидроксида. ОВР.
5 вариант:
Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений:
В2O3 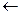 В
В  Н3ВО3
Н3ВО3  Na2В4О7
Na2В4О7  Н3ВО3
Н3ВО3  NaВО2
NaВО2  В(OC2H5)3
В(OC2H5)3
15. Алюминий, его оксид и гидроксид – амфотерные. Закончите уравнения реакций: AI + NaOH + H2O  , AI2(SO4)3 + NaOH(ИЗБ) , AI2(SO4)3 + NaOH(ИЗБ)  , AI(OH)3 + H2SO4 , AI(OH)3 + H2SO4  , AI(OH)3 + NaOH , AI(OH)3 + NaOH  . Назовите образовавшиеся продукты. . Назовите образовавшиеся продукты. | 15. Алюминий – типичный амфотерный элемент. В щелочной среде он образует анионные гидроксокомплексы, в кислой – катионные аквакомплексы. |
Bаморф + KOH + H2O  Бор - восстановитель, водород-катион окислитель.
Бор - восстановитель, водород-катион окислитель.
6 вариант:
Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений:
Al  Al(OH)3 ® Al(NO3)3 ® Al2O3 ® Al ® Na3[Al(OH)6]
Al(OH)3 ® Al(NO3)3 ® Al2O3 ® Al ® Na3[Al(OH)6]  [Al(H2O)6]Cl3
[Al(H2O)6]Cl3  Al(OH)3
Al(OH)3
Составьте молекулярное и ионное уравнение совместного гидролиза: AI2(SO4)3 + Na2CO3 + H2O  | Сульфат алюминия гидролизуются по катиону, карбонат натрия – по аниону. При смешении растворов этих солей равновесие реакции их взаимодействия с водой смещается в сторону усиления гидролиза, до образования конечных продуктов. |
AI + K2Cr2O7 + HCI  ОВР, хром окислитель, восстанавливается до с.о. +3, алюминий восстановитель.
ОВР, хром окислитель, восстанавливается до с.о. +3, алюминий восстановитель.
ТЕМА 4: ХИМИЧЕСКИЕ СВОЙСТВА р – ЭЛЕМЕНТОВ 4 ГРУППЫ ПС И ИХ СОЕДИНЕНИЙ
Комментарии для работы с рабочими тетрадями.
_
1. C + H2O  синтез газ. ОВР. синтез газ. ОВР. |
2. CO + Ni  карбонилы никеля с координационным числом 4. карбонилы никеля с координационным числом 4. |
3. NaHCO3  разлагается при температуре. Не ОВР. разлагается при температуре. Не ОВР. |
4. CO + CuO  угарный газ один из промышленных востановителей металлов из их оксидов. Аналогично восстанавливают медь углеводороды, окисляясь до углекислого газа. угарный газ один из промышленных востановителей металлов из их оксидов. Аналогично восстанавливают медь углеводороды, окисляясь до углекислого газа. |
5. K2CO3 + H2O  гидролиз по аниону. гидролиз по аниону. |
6. Mg2Si + H2SO4  реагция обмена между катионами и анионами. реагция обмена между катионами и анионами. |
7. SnO + KOH + H2O  Комплексообразование, у Sn 2+ координационное число 4. Комплексообразование, у Sn 2+ координационное число 4. |
8. PbO2 + KBr + H2SO4  ОВР Br-1 -восстановитель, окислитель- Pb +4. ОВР Br-1 -восстановитель, окислитель- Pb +4. |
9. Pb + HNO3 k  ОВР. Свинец до (+2), азот до (+4). ОВР. Свинец до (+2), азот до (+4). |
10. C + CO2  реакция соединения. ОВР. реакция соединения. ОВР. |
11. C + Fe  реакция соединения (цементит) реакция соединения (цементит) |
12. C + NH3  один из продуктов - синильная кислота. один из продуктов - синильная кислота. |
13. CO2 + BaO2  ОВР О-1 диспропорционирует. ОВР О-1 диспропорционирует. |
14. Si + KOH + H2O  образуется соль кремниевой кислоты и водород. ОВР. образуется соль кремниевой кислоты и водород. ОВР. |
15. SiO2 + HF  реагция обмена между катионами и анионами. реагция обмена между катионами и анионами. |
16. SnCI2 + NaOH изб  обмен и Комплексообразование у. Sn 2+ координационное число 4. обмен и Комплексообразование у. Sn 2+ координационное число 4. |
17. Sn + HNO3 p  ОВР с образованием соли олова (2). ОВР с образованием соли олова (2). |
| 18. PbO2 + NaOH + H2O Комплексообразование у Pb 4+ координационное число 6. |
19. Sn(OH)2  реакция разложения. реакция разложения. |
20. SnCI2 + H2O2 + HCI  ОВР O -1 окислитель, восстановитель Sn +2 до (+4). ОВР O -1 окислитель, восстановитель Sn +2 до (+4). |
21. C + O2  ОВР ОВР |
22. C + CaO  ОВР ОВР |
23. (CuOH)2CO3  разложение малахита. Не ОВР. разложение малахита. Не ОВР. |
24. CO + Cr  карбонилы хрома имеют координационное число 4 карбонилы хрома имеют координационное число 4 |
25. CO2 + Na2O2  ОВР О-1 диспропорционирует. ОВР О-1 диспропорционирует. |
26. SiH4 + O2  сгорает до оксидов сгорает до оксидов |
27. SnCI2 + H2O  гидролиз по катиону гидролиз по катиону |
28. PbO + Pb2O3  образуется метаплюмбат свинца (2) по фрормуле аналогичен железной окалине. образуется метаплюмбат свинца (2) по фрормуле аналогичен железной окалине. |
29. Pb3O4 + KJ + H2SO4  ОВР J-1 восстановитель, окислитель Pb +3. ОВР J-1 восстановитель, окислитель Pb +3. |
30. C + SiO2  ОВР ОВР |
31. CO + Mn  карбонилы марганца имеют координационное число 4 карбонилы марганца имеют координационное число 4 |
32. CO2 изб + NaOH  кислая соль – соединение. Не ОВР. кислая соль – соединение. Не ОВР. |
33. Si + HF + HNO3  ОВР. кремний восстановитель, азот окислитель до +4. ОВР. кремний восстановитель, азот окислитель до +4. |
34. Na2SiO3 + CO2 + H2O  Обмен. Более сильная кислота вытесняет более слабую из её соли. Обмен. Более сильная кислота вытесняет более слабую из её соли. |
35. Sn(OH)2  разложенние разложенние |
36. Sn + HNO3 к  один из продуктов оловянная кислота, азот востанавливается до +4. один из продуктов оловянная кислота, азот востанавливается до +4. |
37. PbS + O2  обжик сульфидов до оксидов, оксид свинца аналогичен железной окалине. обжик сульфидов до оксидов, оксид свинца аналогичен железной окалине. |
38. PbO2 +KBr + H2SO4  ОВР с образованием соли свинца (2). ОВР с образованием соли свинца (2). |
39. Pb(OH)2  разложение до оксидов. разложение до оксидов. |
40. H2C2O4 + KMnO4 + H2SO4  углерод окисляется до +4 марганец восстанавливается в кислой среде до +2. углерод окисляется до +4 марганец восстанавливается в кислой среде до +2. |
1 вариант:
Какую степень окисления может проявлять кремний в своих соединениях? Составьте уравнения реакций, которые надо провести для осуществления превращений:
Mg2Si ® SiH4 ® SiO2 ® K2SiO3 ® H2SiO3
С ® CО2 ® СО ® СО2 ® Na2СО3 ® NаНСО3 ® Na2СО3 ® СО2
| Составьте молекулярные и ионные уравнения реакции гидролиза SnCI2. Укажите реакцию среды. Объясните необходимость подкисления раствора SnCI2. | Хлорид олова (II) – соль слабого основания и сильной кислоты, поэтому гидролиз протекает по катиону. Для решения вопроса о необходимости подкисления раствора SnCI2 следует указать направления смещения равновесия процесса гидролиза при добавлении ионов Н+ в соответствии с принципом Ле – Шателье. |
2 вариант:
Какие степени окисления наиболее характерны для олова и для свинца? Составьте электронные и молекулярные уравнения олова и свинца с концентрированной азотной кислотой.
Соединения свинца (II) проявляют восстановительные свойства, а соединения свинца (IV) – окислительные. Закончите уравнения реакций: KI + PbO2 + CH3COOH  , Pb(CH3COO)2 + CI2 + NaOH , Pb(CH3COO)2 + CI2 + NaOH  | Пи взаимодействии с йодидом калия PbO2 восстанавливается до Pb2+, который можно окислить с помощью хлора в щелочной среде до PbO2. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
SiO2 ® Si ® Mg2Si ® SiH4 ® SiO2 ® Na2SiO3 ® H2SiO3 ® H2O
3 вариант:
Опишите физические свойства р-элементов IV группы – простых веществ: агрегатные состояния, наличие аллотропных модификаций.
Закончите уравнения реакций: H2O2 + PbO2  , MnSO4 + PbO2 + HNO3 , MnSO4 + PbO2 + HNO3  Определите коэффициенты электронно-ионным методом. Вычислите эквивалентную массу восстановителя в реакциях. Определите коэффициенты электронно-ионным методом. Вычислите эквивалентную массу восстановителя в реакциях. | PbO2 – сильнейший окислитель в кислой среде. Реакция с сульфатом марганца является качественной на ионы Mn2+. Раствор окрашивается в фиолетовый цвет, что указывает на образование перманганат-ионов. При вычислении эквивалентной массы окислителя(восстановителя) необходимо его молярную массу разделить на число электронов. принятых (отданных) 1 моль окислителя (восстановителя) в данной реакции. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
SiO2 ® Si ® SiF4 ®H2[SiF6] ® Na2SiO3
4 вариант:
Какие соединения являются карбидами и силицидами? Напишите уравнения реакций: а) карбида кальция с водой; б) силицида магния с соляной кислотой. Являются ли эти реакции окислительно-восстановительными?
Диоксид свинца проявляет сильные окислительные свойства. Закончите уравнения реакций: HCI + PbO2  , КBr + PbO2 + H2SO4 , КBr + PbO2 + H2SO4  . Определите коэффициенты электронно-ионным методом. . Определите коэффициенты электронно-ионным методом. | Диоксид свинца – сильный окислитель, окисляет галогенид – ионы до свободных галогенов. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
СO2 ® Si ® SiO2 ® Si ® SiO2 ® K2SiO3 ® K2СO3® O2 ® CO2 ® C ® CF4.
5 вариант:
Хлорид олова(II) широко применяется в химической практике в роли восстановителя. Закончите уравнения реакций: SnCI2 + K2Cr2O7 + HCI  , SnCI2 + HgCI2 , SnCI2 + HgCI2  , SnCI2 + FeCI3 , SnCI2 + FeCI3  . Определите коэффициенты электронно-ионным методом. . Определите коэффициенты электронно-ионным методом. | Соединения Sn(II) легко окисляются до Sn(IV). При этом Сr(VI) переходит Сr3+, Hg2+  Hg Hg  , Fe3+ , Fe3+  Fe2+ Fe2+ |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
С ® CО2 ® СО ® СО2 ® Na2СО3 ® NаНСО3 ® Na2СО3 ® СО2
| Напишите уравнения реакции растворения свинца в горячем растворе щелочи и назовите полученное соединение. | Свинец взаимодействует с горячим растворами щелочей с образованием комплексного соединения с координационным числом 4 и водорода. |
6 вариант:
Составьте уравнение реакций, описывающие следующие превращения: H2SnO3  Sn Sn  SnCI2 SnCI2  Sn(OH)2 Sn(OH)2  Na2[Sn(OH)4] Na2[Sn(OH)4]  Na2[Sn(OH)6]. Для окислительно-восстановительных реакций определите коэффициенты электронно-ионным методом. Na2[Sn(OH)6]. Для окислительно-восстановительных реакций определите коэффициенты электронно-ионным методом. | Соляная кислота окисляет олово до хлорида олова (II), концентрированная азотная – до 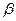 - лолвянной кислоты. Гидроксид олова (II), осаждаемый действием щелочей на соли олова (II), амфотерен, растворяется в избытке щелочей с образованием гидроксокомплекса олова(II), которые являются сильными восстановителями и переводят Bi3+в Bi0, Fe3+ в Fe2+, СrО - лолвянной кислоты. Гидроксид олова (II), осаждаемый действием щелочей на соли олова (II), амфотерен, растворяется в избытке щелочей с образованием гидроксокомплекса олова(II), которые являются сильными восстановителями и переводят Bi3+в Bi0, Fe3+ в Fe2+, СrО 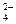 в Сr3+. в Сr3+. |
Закончите уравнения реакций: SnCI2 + BiCI3+ NaOH(изб)  Na2[Sn(OH)6] + … Na2[Sn(OH)6] + … | Соединения олова(II) – сильные восстановители. В избытке щелочи олова(II) находится в виде гидроксокомплекса, висмут(III) – в виде гидроксида. Взаимодействие этих соединений приводит к образованию гидрокомплекса олова (IV) с координационным числом 6 и свободного висмута. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
Sn  SnCl2 ® Sn(OH)2® Na2[Sn(OH)4]® Na2[Sn(OH)6]
SnCl2 ® Sn(OH)2® Na2[Sn(OH)4]® Na2[Sn(OH)6]
7 вариант:
Закончите уравнения реакций: Sn + HCI(разб)  , Sn + H2SO4(разб) , Sn + H2SO4(разб)  , Sn + HNO3 (конц) , Sn + HNO3 (конц)  . Определите коэффициенты электронно-ионным методом. . Определите коэффициенты электронно-ионным методом. | Олово – металл, стоящий в электрохимическом ряду напряжений до водорода, вытесняет его из разбавленных растворов кислот – неокислителей. разбавленная азотная кислота окисляет олово до двухвалентного состояния. |
| Укажите состав стекла. Напишите ионные и молекулярные уравнения реакций гидролиза силиката натрия с образованием диметасиликат – иона. | Обычное стекло получают сплавлением смеси соды, известняка и кварцевого песка. Силикат натрия – соль, образованная катионами сильного основания и анионами слабой кислоты, гидролиз происходит происходит по аниону с образованием гидросиликат – ионов, которые при гидротации переходят в диметасиликат – ионы. |
Составьте уравнения реакций, которые надо провести для осуществления превращений:
K2SiO3 ® H2SiO3 ® SiO2 ® Si ® Ca2Si ® SiH4 ® SiO2 ® Na2SiO3 ® Na2ZnO2 .
 2015-10-16
2015-10-16 1581
1581
