Любая система (в том числе и атом) устойчива при минимальной энергии частиц, составляющих данную систему (при минимальной внутренней энергии).
В многоэлектронных атомах энергия электрона зависит не только от главного, но и от орбитального квантового числа. Главное квантовое число (n) определяет некоторую энергетическую зону, в пределах которой точное значение энергии электрона определяется величиной l – орбитального квантового числа.
Наиболее устойчивое состояние электрона в атоме соответствует минимально возможному значению его энергии. Порядок заполнения электронами энергетических подуровней определяется принципом наименьшей энергии, который сформулировал В.М. Клечковский в виде двух правил:
1. При увеличении заряда ядра атома последовательное заполнение орбиталей происходит от орбиталей с меньшим значением суммы чисел ( n+l) к орбиталям с бóльшим значением этой суммы (происходит в порядке возрастания суммы чисел(n+l)).
2. При одинаковых значениях этой суммы в первую очередь заполняются орбитали с меньшим значением n.
Рассмотрим эти правила на конкретных примерах. Подсчитаем значения суммы чисел (n + l) для орбиталей различных энергетических подуровней и определим порядок заполнения их электронами:
| 1 s | 2 s | 2 p | 3 s | 3 p | 3 d | 4 s | 4 p | |
| (n + l): | 1+0=1; | 2+0=2; | 2+1=3; | 3+0=3; | 3+1=4; | 3+2=5; | 4+0=4; | 4+1=5. |
Как мы видим, наименьшее значение этой суммы соответствует орбиталям s -подуровня первого уровня. Орбиталям s -подуровня второго уровня соответствует наименьшее значение этой суммы из всех приведенных далее. Заполнение их происходит согласно 1-му правилу Клечковского. Две равные суммы чисел (n + l) соответствуют орбиталям подуровней 2 p и 3 s, 3 p и 4 s, 3 d и 4 p, но, согласно 2-му правилу Клечковского, первыми будут заполняться орбитали подуровня с меньшим значением n. Таким образом, порядок заполнения электронами энергетических подуровней следующий: 1 s → 2 s → 2 p → 3 s → 3 p → 4 s → 3 d → 4 p → 5 s → 4 d → 5 p → 6 s → 5 d1 → 4 f → 5 d2–10 → 6 p → 7 s → 6 d1 → 5 f → 6 d2–… …
Из приведенного здесь порядка заполнения электронами энергетических подуровней прослеживается общая закономерность: орбитали d –подуровня предыдущего уровня заполняются позже, чем орбитали s –подуровня внешнего уровня (4 s после 3 d; 4 d после 5 s и т.д.). Исключение составляют орбитали 5 d и 4 f (сначала 1 электрон занимает подуровень 5 d, затем заполняются орбитали 4 f –подуровня и после них продолжает заполняться электронами подуровень 5 d; аналогичное заполнение имеет место у орбиталей подуровней 6 d и 5 f). Запоминать это исключение не обязательно.
В пределах одного подуровня электроны заполняют орбитали в соответствии с правилом Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина максимально (это достигается при заполнении атомных орбиталей сначала по одному электрону).
Поясним это правило на примере.
Предположим, что на р –подуровне какого-то уровня находятся три электрона. Мы можем распределить эти электроны по орбиталям двумя способами: 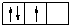 или
или 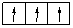 . В первом случае суммарный спин равен:
. В первом случае суммарный спин равен: 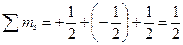 ; во втором случае
; во втором случае 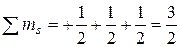 . Во втором случае значение суммарного спина больше, следовательно, такое распределение правильное.
. Во втором случае значение суммарного спина больше, следовательно, такое распределение правильное.
 2015-10-16
2015-10-16 2090
2090








