Прежде чем мы попытаемся установить взаимосвязь между положением элемента в периодической системе Д.И. Менделеева, электронным строением атома элемента и химическими свойствами самого элемента и его соединений, вспомним периодический закон Д.И. Менделеева (1869 г.). В авторской формулировке закон читается так: «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов». Термин «простое тело» означает простое вещество, образованное атомами данного элемента; «форма соединения» – строение соединения, а вместо термина «атомный вес» сейчас используется «относительная атомная масса».
В связи с этой формулировкой вспомним об атомной массе элемента. Ранее уже говорилось, что практически вся масса атома сосредоточена в ядре атома. Плотность массы «ядерного вещества» примерно в 1015 раз больше плотности всего вещества. В состав ядра входят элементарные частицы – протоны и нейтроны. Протон (р) – положительно заряженная частица с массой, равной 1,672∙10–27 кг (или 1,00728 а.е.м.). Абсолютная величина заряда протона равна 1,602∙10–19 Кл; условный заряд протона принимают равным +1. Таким образом, заряд ядра равен числу протонов в нем. Нейтрон (n) – нейтральная частица с массой, равной 1,674∙10–27 кг (или 1,00867 а.е.м.). Масса электрона почти в 1840 раз меньше массы протона, поэтому масса атома практически равна сумме масс протонов и нейтронов. Так как масса атомов чрезвычайно мала, то обычно ее выражают в атомных единицах массы (а.е.м.). В качестве атомной единицы массы принята 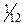 массы атома изотопа углерода 12С.
массы атома изотопа углерода 12С.
А = Z + N,
где А – массовое число (пишут вверху слева у символа элемента); Z – число протонов (заряд ядра), пишут внизу слева у символа элемента; N – число нейтронов.
Однако масса ядра атома лишь приблизительно равна сумме масс протонов и нейтронов, образующих ядро. Если взять точные величины масс протона и нейтрона и подсчитать массы ядер различных элементов, то получается расхождение с экспериментально найденными величинами.
Например, в ядро атома гелия (Не) входят 2 протона и 2 нейтрона. Сумма их масс равна 2∙1,00728 + 2∙1,00867 = 4,03190 (а.е.м.). В действительности масса ядра гелия равна 4,00260 а.е.м., т.е. примерно на 0,03 а.е.м. меньше. Аналогичные результаты получаются при подсчете масс других ядер (масса ядра всегда меньше суммы масс составляющих его протонов и нейтронов). Это явление получило название дефекта массы и объясняется оно выделением энергии при взаимодействии протонов с нейтронами, которое приводит к образованию нуклонов. Чем больше энергии выделяется при образовании ядра, тем оно устойчивее.
При образовании 1 моля атомов гелия дефект массы равен 0,03 г = 3∙10–5 кг. Согласно уравнению Эйнштейна (Е = mc 2), это соответствует выделению 3∙10–5 ∙ (3∙108)2 = 2,7∙1012 Дж энергии.
При построении периодической системы Д.И. Менделеев располагал элементы в порядке возрастания атомных масс и обнаружил, что сходные в химическом отношении элементы встречаются через правильные интервалы и, таким образом, многие свойства элементов периодически повторяются.
Однако в трех случаях Менделеев нарушил этот принцип расположения элементов. Так, аргон (атомная масса 39,948 а.е.м.) стоит до калия (39,098 а.е.м.), кобальт (58,9332 а.е.м.) находится до никеля (58,69 а.е.м.) и теллур (127,60 а.е.м.) – до иода (126,9045 а.е.м.). Здесь ученый отступил от принятого им порядка, исходя из свойств этих элементов, требовавших именно такой последовательности их расположения. Таким образом, он не придавал исключительного значения атомной массе и, устанавливая место элемента в таблице, руководствовался всей совокупностью его свойств.
Действительно, мы знаем, что могут быть атомы одного и того же элемента с разной массой – это изотопы, например, 16 О, 17 О, 18 О; 1 Н, 2 Н, 3 Н; 35 Cl, 37 Cl. Существуют и атомы разных элементов с одинаковой массой – это изобары, например 112 Cd и 112 Sn; 40 Ar и 40 Ca.
Позднейшие исследования подтвердили абсолютную правоту ученого, так как именно такое расположение элементов в таблице соответствует строению атомов. Благодаря исследованиям английского ученого Г. Мозли (1914 г.) было доказано, что заряд ядра атома численно равен порядковому номеру элемента в периодической системе Д.И. Менделеева.
Итак, заряд ядра является той основной величиной, от которой зависят свойства элементов и его положение в периодической системе. Поэтому периодический закон Менделеева в настоящее время формулируют следующим образом: «Свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра атомов элементов».
Периодическая система элементов отражает электронное строение атомов. Каждый период (их в системе 7) начинается элементом, в атоме которого появляется электрон с новым значением главного квантового числа n, при этом номер периода совпадает со значением n внешнего энергетического уровня. Порядковый номер элемента показывает число электронов в атоме, а номер группы (их в системе 8) совпадает с числом валентных электронов.
 2015-10-16
2015-10-16 1938
1938
