Квантовое состояние с наименьшей энергией атома называется нормальным, или основным; остальные квантовые состояния с бóльшими уровнями энергии называются возбужденными. Электрон в нормальном состоянии связан с ядром наиболее прочно. В возбужденном состоянии атома связь электрона с ядром ослабевает (вплоть до отрыва электрона от атома).
В нормальном состоянии атом может существовать неограниченное время, в возбужденном же состоянии – ничтожные доли секунды (~10−8 с).
Возбуждение атома происходит при нагревании, электроразряде, поглощении света и т.д., и в любом случае атом поглощает лишь определенные порции – кванты энергии.
Возможные энергетические состояния атомов элементов можно наглядно представить с помощью графических формул. Обычно учитывают только валентные электроны, так как именно они обусловливают химические свойства и возможные превращения атомов элементов. Рассмотрим на конкретном примере.
Возьмем два р –элемента VII группы – фтор и хлор. Сокращенные формулы их атомов имеют вид: F …2 s 22 p 5; Cl …3 s 23 p 5. Распределим эти электроны по атомным орбиталям уровня, представляя электроны в виде стрелочек.
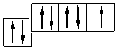
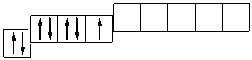
F … n =2; Cl … n =3
s p s p d
Как мы видим, и атому фтора, и атому хлора достаточно принять один электрон до завершения р -подуровня и приобретения устойчивой восьмиэлектронной оболочки инертного газа … ns 2 np 6. Принимая электрон, атомы приобретают степень окисления, равную −1. Степень окисления – это условный заряд атома элемента в соединении, который подсчитывают, исходя из предположения, что вещества состоят из простых ионов. Степень окисления равна числу условно принятых атомом электронов (со знаком «−») или числу условно отданных атомом электронов (со знаком «+»).
В атоме хлора заполняется электронами третий уровень, в пределах которого энергетически возможен d -подуровень. Энергия его достаточно велика, поэтому заполнение его возможно лишь для элементов 4-го периода (мы это ранее объясняли). Однако, если атому хлора сообщить дополнительную энергию, он может перейти в возбужденное состояние, которое сопровождается постепенным распариванием р- и s- электронов и переходом их на d -подуровень. Для атома хлора возможно несколько возбужденных состояний.
Cl …3 s 23 p 5 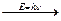 Cl *…3 s 23 p 43 d 1
Cl *…3 s 23 p 43 d 1 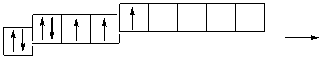
s p d
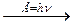 Cl **…3 s 23 p 33 d 2
Cl **…3 s 23 p 33 d 2 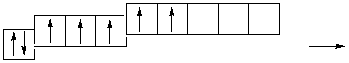
s p d
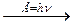 Cl ***…3 s 13 p 33 d 3
Cl ***…3 s 13 p 33 d 3 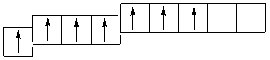
s p d
Атомы хлора в возбужденном состоянии приобретают положительную степень окисления, равную +3, +5, +7 (высшая степень окисления), соответственно.
Валентность, обусловленная числом неспаренных электронов, также различна у этих элементов. Фтор может быть только одновалентным, в то время как хлор за счет возможного перехода в возбужденное состояние может проявлять еще валентность, равную трем, пяти и семи. Так, исходя из электронного строения атомов, мы можем объяснить различные возможности этих элементов в химических превращениях. Более подробно зависимость химических свойств элементов и их соединений от электронного строения атомов элементов разберем ниже.
 2015-10-16
2015-10-16 45390
45390
