Р-ЭЛЕМЕНТЫ VI ГРУППЫ
Мышьяк, сурьма, висмут
Фосфор
Вследствие лёгкой окисляемости фосфор не встречается в природе в свободном состоянии. Наиболее важным природным соединением фосфора является минерал фосфорит Са3(РО4)2.
Для фосфора известны несколько аллотропных модификаций: белый, красный, черный фосфор:
1) Белый фосфор – очень сильный яд, даже малые дозы которого смертельны.
2) Красный фосфор не ядовит так как имеет полимерную структуру. При нагревании красный фосфор сублимируется, а при охлаждении паров получается белый фосфор.
3)Чёрный фосфор образуется при нагревании белого фосфора без доступа воздуха при очень высоком давлении. Внешне чёрный фосфор похож на графит и обладает полупроводниковыми свойствами.
Свободный фосфор непосредственно взаимодействует со многими веществами: с кислородом, галогенами, активными металлами. При сгорании фосфора в кислороде или на воздухе образуется Р2О5 – белое твёрдое вещество, обладающее сильными водоотнимающими средствами
4Р + 5О2 ↔ 2Р2О5.
Оксиду фосфора (V) соответствует Н3РО4 – слабая трёхосновная кислота
Р2О5 + 3Н2О = 2Н3РО4.
Известны также следующие слабые кислоты фосфора:
1) Фосфористая(Н3РО3) – двухосновная,
2) Фосфорноватистая(Н3РО2) – одноосновная.
Соли фосфорной кислоты применяются в сельском хозяйстве в качестве минеральных удобрений.
Мышьяк и все его соединения - сильные яды! Применяется в сельском хозяйстве в качестве инсектицида.
Сурьма - серебристо-белое вещество с металлическим блеском. От металлов сурьма отличается хрупкостью и низкой электропроводностью. Сурьму вводят в некоторые сплавы (гарт) для придания им твердости. Соединения сурьмы сходны с соединениями мышьяка.
Висмут в свободном состоянии - розово-белый металл. Металлический висмут не растворяется в разбавленных HCl и H2SO4, но растворяется в разбавленной азотной и горячей концентрированной серной кислотах. Соединения висмута (+5) обладают сильными окислительными свойствами.
Металлический висмут используется, главным образом, в ядерной энергетике в качестве теплоносителя. Соединения висмута (+3) применяются в медицине.
К р-элементам VI группы относятся кислород (О), сера (S), селен (Sе), теллур(Те), полоний (Ро).
На рисунке 2 приведены энергетические диаграммы валентных зон данных элементов в основном и возбужденном состояниях.
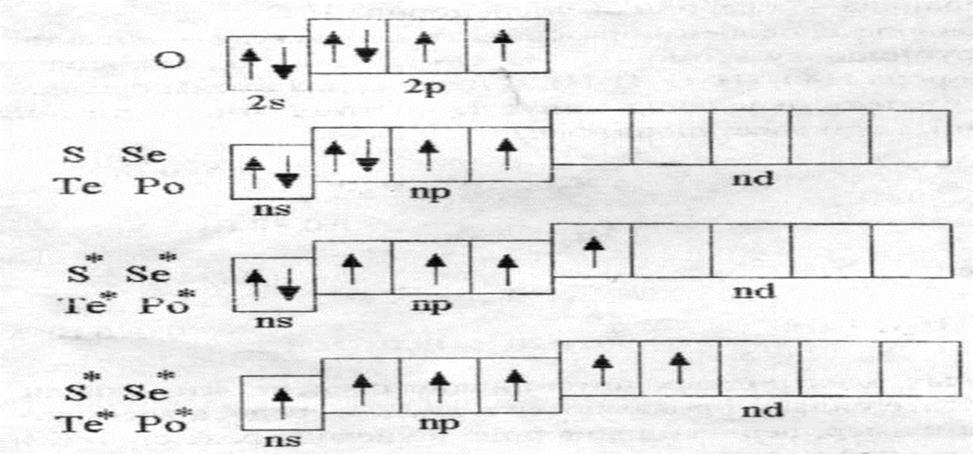
Рисунок 2. Энергетические диаграммы валентных зон р-элементов VI группы
Из приведенного рисунка видно, что на внешнем электронном слое атомов рассматриваемых элементов находится шесть электронов и они могут проявлять четные валентности 2, 4, 6. У атома кислорода отсутствует d-подуровень, поэтому возбужденные состояния отсутствуют и валентность кислорода равна только 2.
Все элементы данной подгруппы, за исключением полония, неметаллы.
 2014-02-09
2014-02-09 1367
1367
