Неметаллические, или окислительные свойства элементов характеризует сродство к электрону. Сродством к электрону Е называется энергия, которая выделяется при присоединении электрона к атому, молекуле или радикалу. Она выражается в тех же единицах, что и энергия ионизации. Чем больше сродство к электрону, т.е. чем больше энергии выделилось при присоединении электрона, тем прочнее удерживается электрон взявшей его частицей, тем сильнее выражены у элемента окислительные свойства.
Атомы элементов – окислителей, принимая электроны, превращаются в отрицательно заряженные ионы. Энергия сродства к электрону атомов (как и энергия ионизации) закономерно изменяется в соответствии с характером электронных структур атомов.
В пределах периода с ростом порядкового номера элемента атомный радиус уменьшается, так как заполняется электронами один и тот же энергетический уровень, а заряд ядра растет, следовательно, увеличивается и притяжение ядром внешних электронов. Наибольшее уменьшение радиусов наблюдается у элементов малых периодов, у которых происходит заполнение электронами внешнего энергетического уровня. В больших периодах у d – и f –элементов наблюдается более плавное уменьшение радиусов при увеличении заряда ядра атома.
В связи с уменьшением атомного радиуса у р –элементов, уменьшением числа электронов, недостающих до завершения внешнего уровня, и увеличением силы притяжения электронов ядром в периодах слева направо возрастает у элементов сродство к электрону, а следовательно, и окислительные, т.е. неметаллические свойства. Самым высоким сродством к электрону обладают галогены (элементы VIIA группы), т.к. при присоединении одного электрона к нейтральному атому они приобретают законченную электронную конфигурацию благородного газа.
В пределах подгруппы с увеличением порядкового номера элемента (сверху вниз) атомный радиус увеличивается, поэтому ослабевает сила притяжения ядром принимаемых электронов и вместе с этим уменьшается сродство к электрону, а следовательно, и окислительные (неметаллические) свойства элементов. Поэтому самым сильным окислителем является фтор. И если с синтезом новых элементов, т.е. с дальнейшим развитием периодической системы Д.И. Менделеева, мы можем ожидать элемент с более выраженными металлическими свойствами, чем у франция, то более активного, чем фтор, неметалла быть не может.
Для решения вопроса о том, какой из атомов легче отдает или принимает электроны, учитывают оба фактора: и энергию ионизации, и сродство к электрону. Такой обобщающей характеристикой элемента служит электроотрицательность – ЭО, которую принимают равной полусумме энергии ионизации и сродства к электрону:
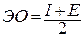 .
.
Электроотрицательность характеризует способность атомов элементов принимать электроны при образовании ионной связи или оттягивать на себя общую электронную пару при образовании ковалентной связи. Чем выше электроотрицательность элемента, тем сильнее проявляются у него эти тенденции. При учете обеих энергий нивелируется неоднозначное изменение энергии ионизации у элементов одного периода с ростом порядкового номера и электроотрицательность изменяется однозначно в пределах периода и подгруппы. Электроотрицательность возрастает в направлении слева направо для элементов каждого периода и уменьшается в направлении сверху вниз для элементов одной подгруппы периодической системы Д.И. Менделеева.
Учитывая сложность определения величины сродства к электрону, американский ученый Полинг предложил термохимическую систему, согласно которой электроотрицательности атомов А и В определяют, исходя из энергий связей А – В, А – А и В – В.
Зная закономерности изменения электроотрицательности элементов, мы можем судить и о закономерности изменения свойств соединений, образуемых элементами (табл.2).
Таблица 2
Электроотрицательность элементов по Полингу
| Н 2,1 | ||||||
| Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 |
| Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P 2,1 | S 2,5 | Cl 3,0 |
| K 0,8 | Ca 1,0 | Ga 1,6 | Ge 1,8 | As 2,0 | Se 2,4 | Br 2,8 |
| Rb 0,8 | Sr 1,0 | In 1,7 | Sn 1,8 | Sb 1,9 | Te 2,1 | I 2,5 |
| Cs 0,8 | Ba 0,9 | Tl 1,8 | Pb 1,8 | Bi 1,9 | Po 2,0 | At 2,2 |
| Fr 0,7 | Ra 0,9 |
Рассмотрим водородные соединения галогенов: HCl, HBr, HI. По своему характеру эти соединения являются кислотами, так как в водных растворах диссоциируют с образованием ионов Н +. Степень диссоциации электролита, а следовательно и относительная сила его зависят от полярности связи в молекуле электролита: чем более полярна связь, тем легче она разрывается в среде полярного растворителя, тем более сильным электролитом является растворяемое вещество. Полярность связи определяется разностью электроотрицательностей элементов, образующих молекулу: чем она больше, тем полярнее связь, т.е. тем сильнее смещено электронное облако, осуществляющее связь, к одному из атомов.
Приведенные молекулы образованы элементами одной подгруппы – хлором, бромом и иодом. Так как электроотрицательность в пределах подгруппы уменьшается сверху вниз, то наибольшая ЭО будет у хлора, поэтому самая полярная связь будет в молекуле HCl, и соляная кислота будет самой сильной из приведенных кислот.
С другой стороны, в этих молекулах атомы галогенов проявляют отрицательную степень окисления, равную –1, т.е. мы условно считаем, что каждый из них принял по одному электрону от атома водорода, поэтому все соединения могут проявлять восстановительные свойства. Так как электроотрицательность убывает от хлора к брому и далее к иоду, то взятый электрон будет удерживаться наиболее прочно ядром атома хлора (он взят на наиболее близкий к ядру, третий, уровень), а наименее прочно – ядром атома иода. Поэтому восстановительные свойства в большей степени проявляются HI (это очень сильный восстановитель, часто используемый в органической химии).
Рассмотрим кислородсодержащие кислоты хлора, в молекулах которых хлор проявляет различные степени окисления:
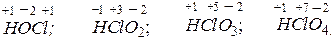
хлорноватистая хлористая хлорноватая хлорная
кислота; кислота; кислота; кислота.
Во всех этих кислотах хлор, проявляя положительную степень окисления, может быть окислителем. Изменение кислотных свойств и окислительной способности данных соединений можно выразить следующей схемой:
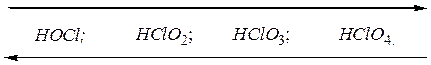 Усиление кислотных свойств, повышение устойчивости
Усиление кислотных свойств, повышение устойчивости
Усиление окислительной активности.
С увеличением степени окисления хлора устойчивость его кислородных кислот растет, растет и сила кислот: самая слабая кислота – хлорноватистая, самая сильная – хлорная. Хлорная кислота – самая сильная кислота из всех известных кислот вообще.
Окислительные свойства в этом ряду соединений, наоборот, ослабевают. Наиболее сильный окислитель – хлорноватистая кислота, наименее сильный – хлорная кислота.
Такая закономерность – усиление кислотных свойств гидроксида (и, соответственно, ослабление его основных свойств) с ростом степени окисления элемента характерна не только для хлора, но и для других элементов. В первом приближении эту закономерность можно объяснить, рассматривая все связи в молекулах гидроксидов как чисто ионные:
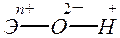
Диссоциация на ионы такой молекулы возможна либо с разрывом связи Э—О (отщепляется ион ОН–), либо с разрывом связи О—Н (что приводит к отщеплению иона Н+). В первом случае гидроксид проявляет свойства основания, во втором – свойства кислоты. При возрастании степени окисления элемента Э увеличивается заряд иона Эn+, что усиливает его притяжение к иону О 2–. Вместе с тем усиливается отталкивание одноименно заряженных ионов Эn+ и Н+, что облегчает диссоциацию по кислотному типу. Таким образом, с увеличением степени окисления элемента усиливаются кислотные свойства и ослабевают основные свойства образуемого им гидроксида.
Увеличение радиуса Эn + при неизменном его заряде приведет к возрастанию расстояний между центром этого иона и центрами ионов О 2– и Н +. В результате взаимное электростатическое притяжение ионов Эn + и О 2– уменьшится, что облегчит диссоциацию по основному типу; одновременно уменьшится взаимное отталкивание ионов Эn + и Н +, так что диссоциация по кислотному типу затруднится. Следовательно, с возрастанием радиуса иона элемента (при неизменном его заряде) усиливаются основные свойства и ослабляются кислотные свойства образуемого им гидроксида. Это можно проследить на примере одинаковых кислородсодержащих кислот галогенов:
HOCl – HOBr – HOI.
В этом ряду самой сильной кислотой будет HOCl, а самой слабой – HOI.
Поскольку предположение о чисто ионной природе всех связей в молекулах гидроксидов может быть высказано со значительной долей погрешности, рассмотренная схема влияния заряда и размеров иона Эn + на характер диссоциации молекулы Э (ОН) n не может служить основой для количественной оценки кислотно-основных свойств гидроксидов. Однако при сопоставлении кислотно-основных свойств различных гидроксидов, образуемых данным элементом в разных степенях окисления, или при сопоставлении свойств аналогичных гидроксидов, образуемых элементами одной и той же подгруппы периодической системы, эта схема в большинстве случаев приводит к правильным качественным выводам.
В заключение о некоторых особенностях строения и свойств d –элементов. При заполнении в атомах элементов электронами d –подуровня от одного до пяти атомный радиус элемента уменьшается, а при дальнейшем заполнении подуровня до 10 электронов атомный радиус увеличивается. Поэтому d –элементы делят на два семейства. Сокращенные электронные формулы атомов элементов первого семейства … ns 2(n – 1) d 1 – … ns 2(n – 1) d 5, атомов элементов второго семейства – … ns 2(n – 1) d 6 – … ns 2(n – 1) d 10. Для элементов первого семейства характерны соединения в высшей степени окисления (совпадающей с номером группы), сходные по свойствам с соединениями р -элементов тех же групп в высшей степени окисления.
Для элементов второго семейства, кроме Fe +6, Ru +8, Os +8, характерны низкие степени окисления, и в своих соединениях элементы проявляют только металлические свойства.
 2015-10-16
2015-10-16 17170
17170








