Форма орбиталей и облаков характеризуется побочным (орбитальным) квантовым числом l.
Для орбиталей данного энергетического уровня побочное (орбитальное) квантовое число l принимает значения целых чисел от 0 до п -1.
Орбитали, для которых l = 0, имеют форму шара (сферы) и называются s-орбиталями (условно изображаются в виде окружности, рис. 3).
Орбитали, для которых l =1, имеют форму гантели (объемной восьмерки) и называются р -орбиталями (рис. 4).
Орбитали с большими значениями l имеют более сложную форму и обозначаются так:
l = 2: d -орбитали (четырехлистника);
l = 3: f -орбитали (шестилистника).
Энергия орбиталей (Е), которые находятся на одном энергетическом уровне, но имеют различную форму, неодинакова:
Еs < Еp <Еd < E f.
Поэтому энергетические уровни состоят из энергетических подуровней.
Значит, орбитали одного подуровня имеют одинаковые значения главного квантового числа (п) и одинаковые значения побочного квантового числа (l).
Энергетический подуровень обозначается так: главное квантовое число записывают арабской цифрой; побочное квантовое число записывают соответствующей латинской буквой (s, p, d, f и т. д.). Например; 1s — s-подуровень первого энергетического уровня (п= 1, l = 0); 4 d — d -подуровень четвертого энергетического уровня (п = 4, l = 2). Число значений l для каждого уровня равно главному квантовому числу. Поэтому число подуровней на уровне тоже равно главному квантовому числу.
Орбитали одного подуровня отличаются направлением (ориентацией) в пространстве.
3. Магнитное квантовое число m; характеризует направление орбиталей (электронных облаков) в пространстве.
Магнитное квантовое число принимает значения целых чисел от - l через 0 до +l.
Число значений m, определяет число орбиталей на подуровне; например:
s-подуровень: l = 0; m = 0 s - орбиталь (рис. 1).
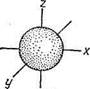 |
Рис. 1. Форма и направление s-электронной орбитали
р-подуровень: l= 1; m l = - 1, 0, +1.
Все три р -орбитали взаимно перпендикулярны, они направлены вдоль осей пространственных координат, поэтому их часто обозначают как рх-, рy - и рz-орбитали. Такое обозначение указывает пространственную направленность p-орбиталей (рис. 2).
z
z
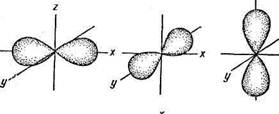
px py pz
Рис 2. Форма и направление р -электронных орбиталей
Еще более сложные формы имеют d -орбитали (их пять) и f -орбитали (их семь).
Число орбиталей на подуровне равно: 2l + 1.
Графически любая орбиталь изображается в виде клетки (квантовой ячейки): ÿ
s -подуровень: ÿ
р -подуровень:ÿÿÿ
d -подуровень: ÿÿÿÿÿ
f -подуровень: ÿÿÿÿÿÿÿ
Итак, каждая орбиталь и электрон, который находится на этой орбитали, характеризуются тремя квантовыми числами: главным п, побочным l и магнитным m l
Электрон характеризуется еще одним — спиновым квантовым числом.
4. Спиновое квантовое число (спин электрона) ms характеризует вращение электрона вокруг своей оси и принимает только два значения: +1/2 и -1/2.
Электрон со спином +1/2 условно изображают так:; со спином -1/2- ¯.
Принцип Паули гласит:
· В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
Поэтому на одной орбитали не может быть больше двух электронов; эти два электрона имеют одинаковый набор трех квантовых чисел (п, l, т) и должны отличаться спинами (спиновым квантовым числом ms): ¯(табл. 3).
 2014-02-02
2014-02-02 5318
5318








