Распределение электронов по энергетическим уровням и орбиталям назы- вается электронной конфигурацией или электронной формулой.
При записи электронной формулы атома записывают энергетический уро- вень (1, 2, 3…либо К, L, М….), а затем буквами s, p, d, f-орбитали, а вверху справа над буквой – суммарное число электронов на данных орбиталях. Например, запись 2р4 означает, что во втором электронном слое на р-орбита- лях находится четыре электрона.
Последовательность заполнения электронами орбиталей различных элек- тронных уровней можно представить следующим образом:
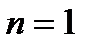
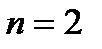
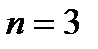
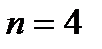
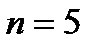
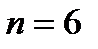
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 ……..
Принято записывать электронную структуру атомов и графическими электронными формулами – с помощью энергетических или квантовых ячеек.
Каждая ячейка обозначается клеткой: клетка – орбиталь. В клетку вписы- вается стрелка. Стрелка обозначает электрон. Стрелка направленная вверх – электрон с положительным спином, стрелка направленная вниз – электрон с отрицательным спином. Свободная клетка – свободная орбиталь, в ней нет электрона. Исходя из принципа В.Паули, в ячейке может быть один (неспа- ренный) или два (спаренных) электрона, но не более двух.
Например, запись электронных формул углерода, азота, кислорода, фтора, серы, хлора и т.п.
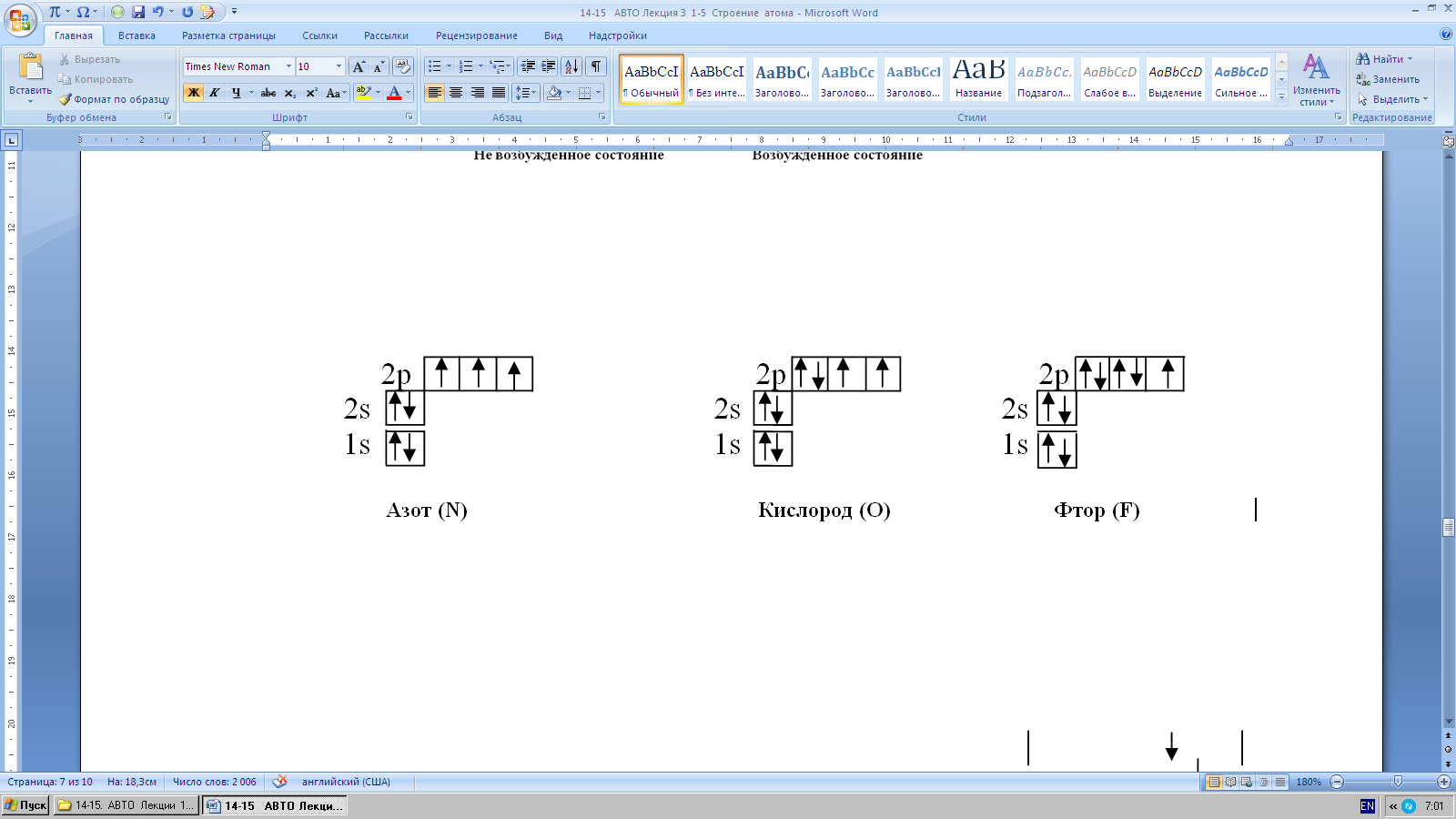
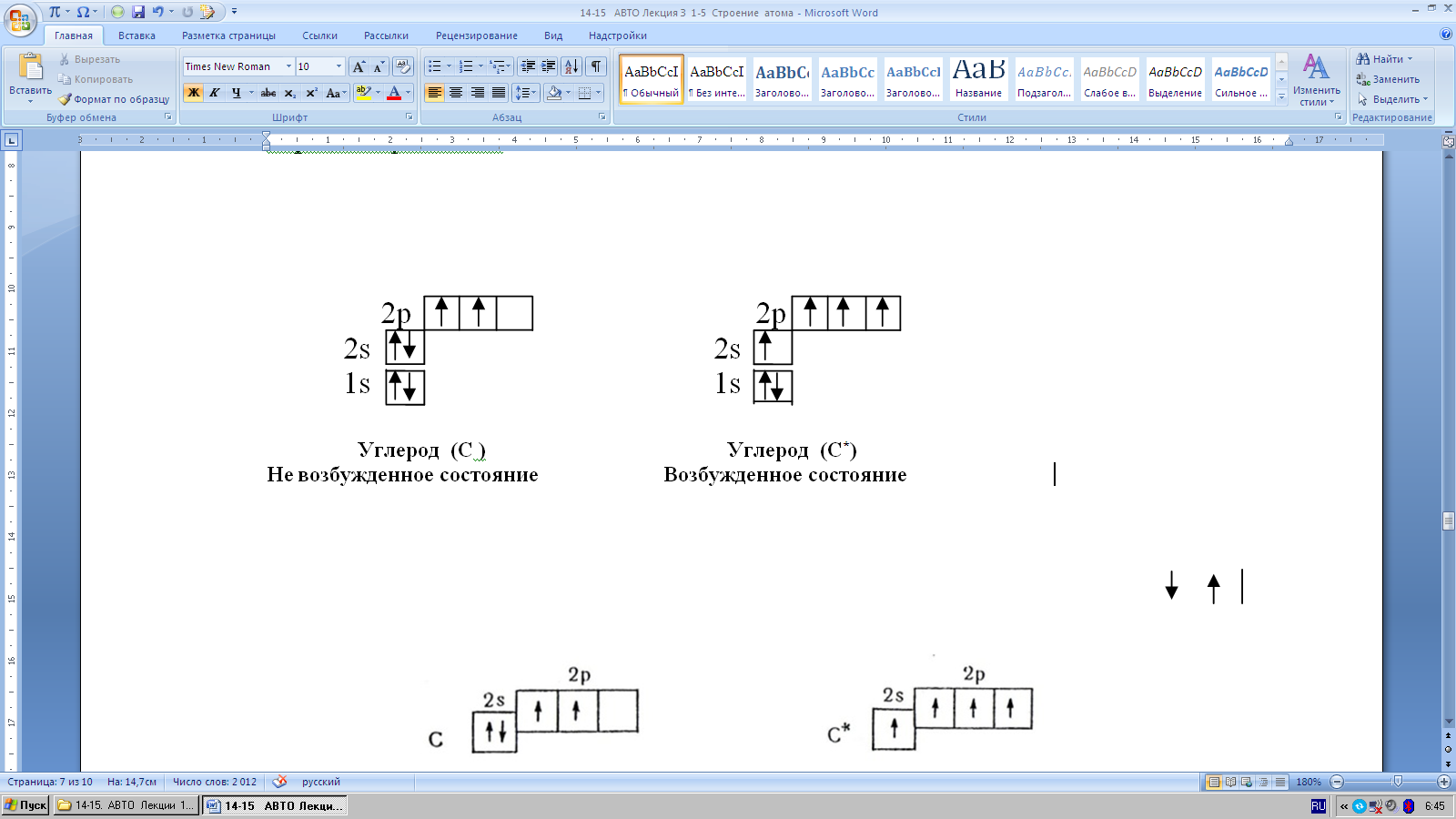
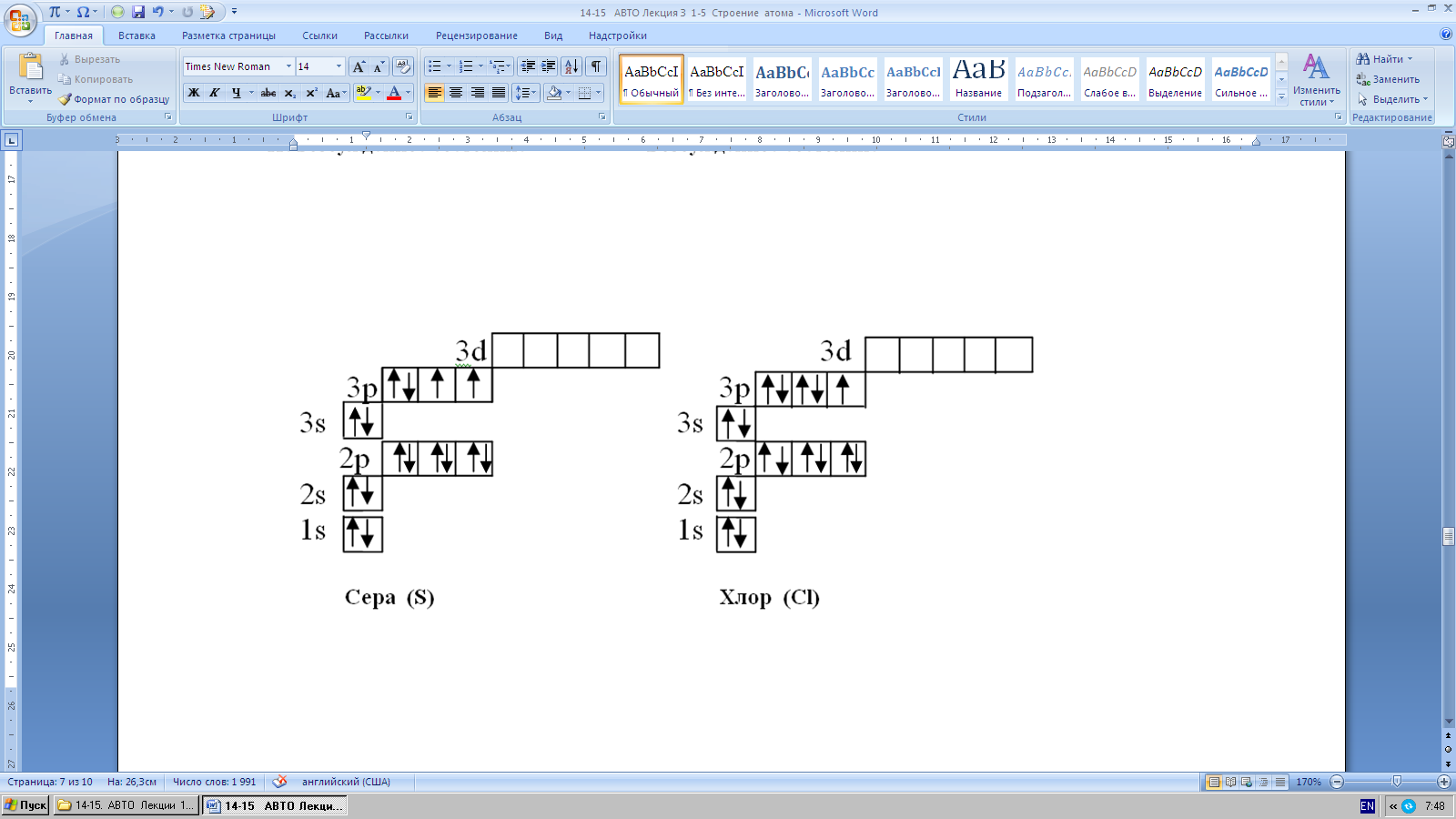
 Максимальное количество электронов на внешнем слое у всех элементов, кроме водорода и гелия, равна восьми. Во втором снаружи электронном слое не бывает более 18 электронов.
Максимальное количество электронов на внешнем слое у всех элементов, кроме водорода и гелия, равна восьми. Во втором снаружи электронном слое не бывает более 18 электронов.
Наличие во внешнем электронном слое восьми электронов придает атому особую устойчивость. Атомы благородных газов, имеющие во внешнем слое восемь электронов, практически не вступают в химические реакции (а если вступают, то с большим трудом).
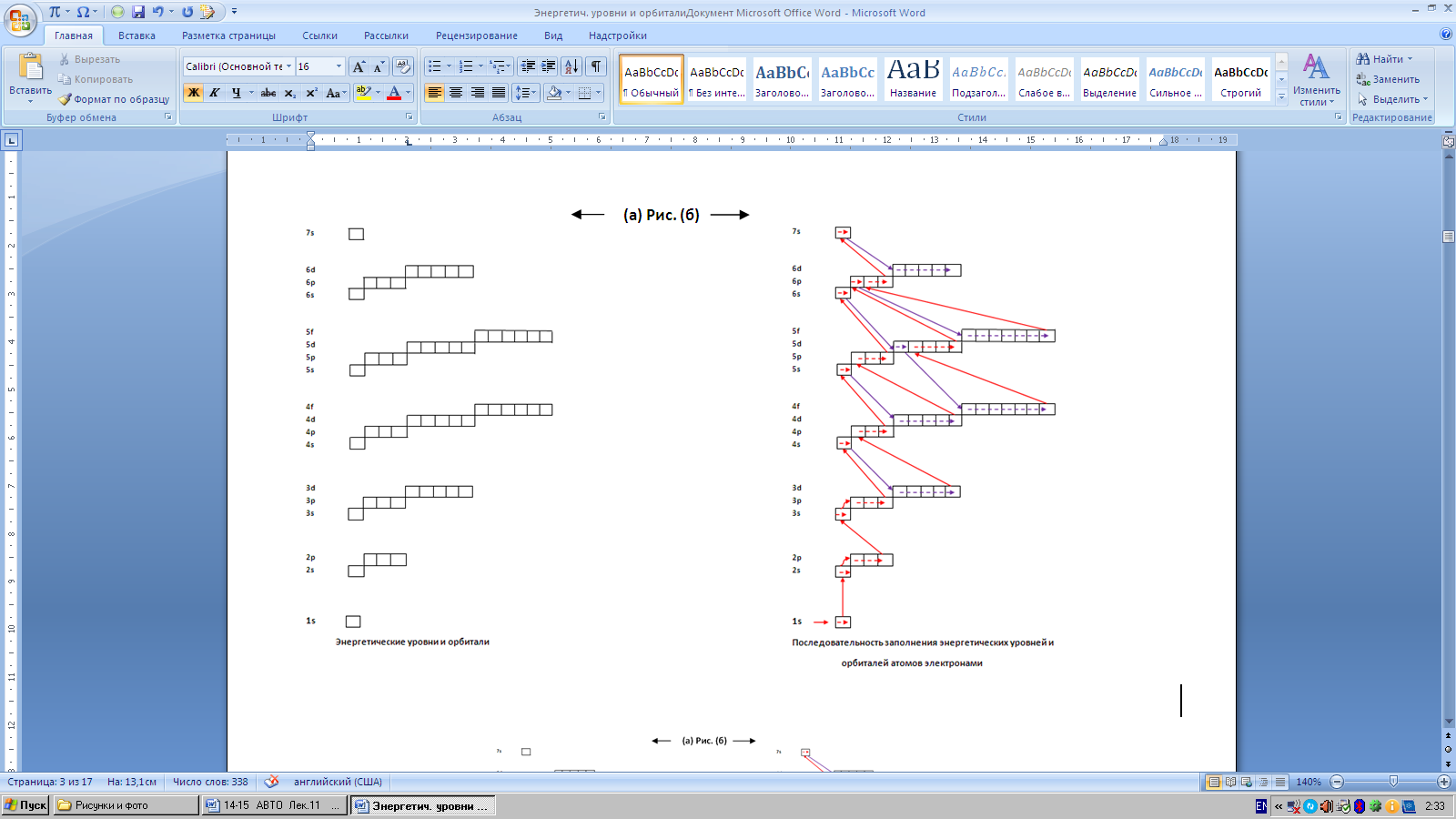
Количество энергетических уровней и орбиталей, и последовательность заполнения энергетических уровней и орбиталей отражены на рисунках
(а) и (б):
 2015-10-16
2015-10-16 996
996








