Рассмотрим некоторые примеры этой взаимосвязи:
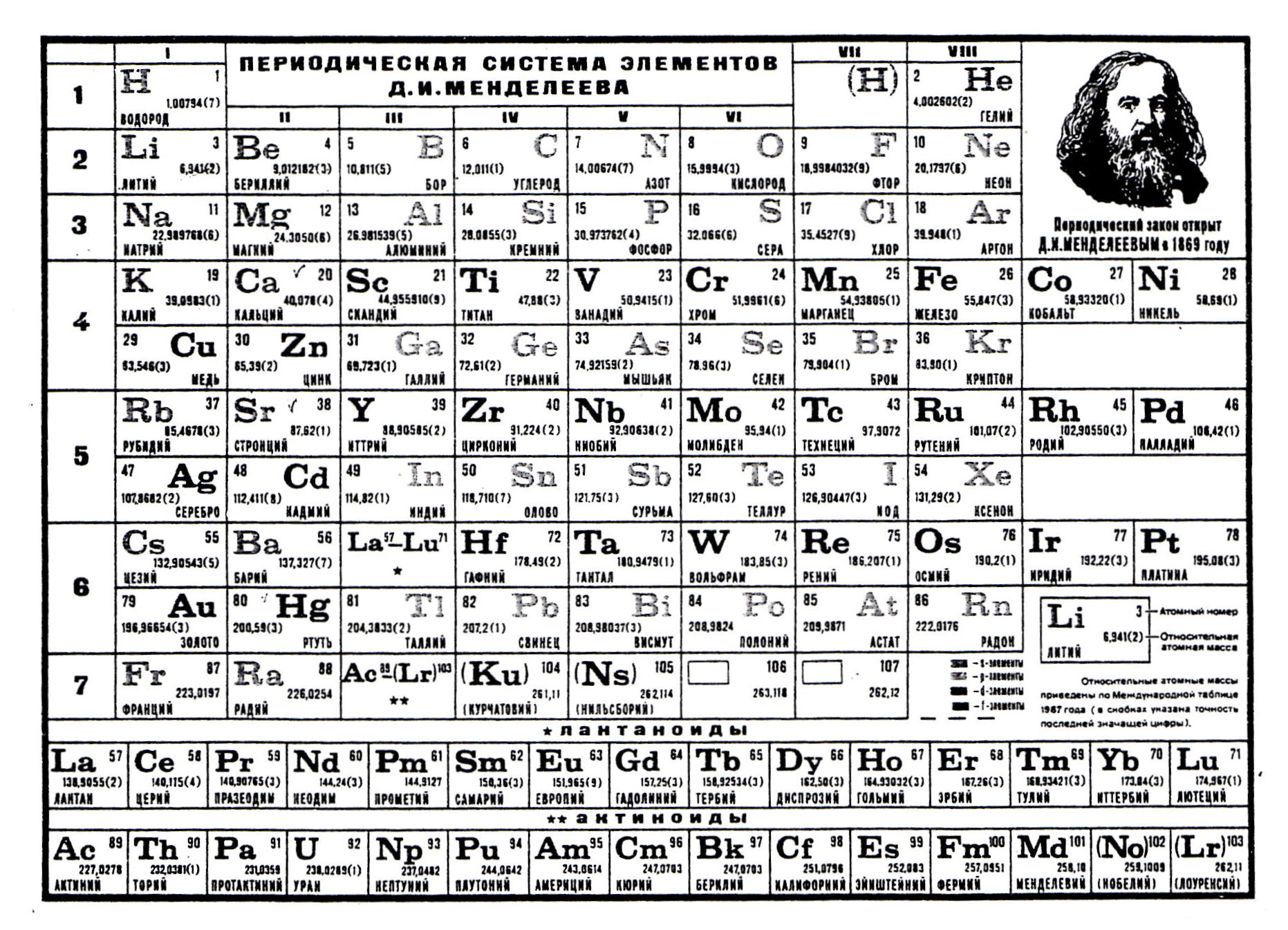
1. Атомный номер элемента соответствует заряду ядра атома.
Атомный номер (заряд ядра атома) соответствует количеству электронов, вращающихся вокруг ядра.
2. Количество энергетических уровней равно номеру периода.
3. Номер группы (отображающий валентность элементов) соответствует количеству электронов на внешнем электронном слое.
4. В каждой подгруппе объединены элементы, атомы которых имеют сход- ное строение внешнего электронного уровня.
Выводы:
1. Атом – сложная частица, состоящая из положительно заряженного ядра, и отрицательно заряженного электрона (ов).
Электроны - отрицательно заряженные частицы, которые обращаются вокруг ядра по энергетическим уровням (орбиталям)
Протон - положительно заряженная частица ядра атома.
Нейтрон - электронейтральная частица ядра атома.
Нуклон - протоны и нейтроны (вместе) ядра атома.
Ядерные силы - силы, удерживающие протоны и нейтроны в ядре.
«Принципа Паули» - в каждой орбитали (подуровне), может находится
не более двух электронов.
Главное квантовое число n (номер уровня) -номер энергетического уровня.
Орбитальное (побочное) квантовое число или подуровень -отражает количество подуровней и общее количество орбиталей на уровне.
Магнитное квантовое число m – отражает форму электронной орбитали
Спиновое квантовое число, ms –вращение электрона вокруг своей оси (по часовой стрелке +, против часовой стрелки -).
Электронная конфигурация или электронная формула атома -распределение электронов по энергетическим уровням и орбиталям.
2. Установлена взаимосвязь между строением атомов, химическими свой- ствами элементов и их положением в периодической системе Д.И.Менделе- ева.
 2015-10-16
2015-10-16 602
602







