2.1 Уравнения основных реакций:
Kbr + H2SO4 ——® Hbr + KHSO4

2.2 Уравнения побочных реакций:
а) дегидратация спирта до простого эфира:

б) окисление спирта серной кислотой:
CH3CH2OH + 6 H2SO4 ¾¾®2 CO2 + 6 SO2 + 9 H2O
в) окисление бромистого водорода серной кислотой:
2 hbr + H2SO4 ¾¾® Br2 + SO2 + H2O
Свойства бромистого этила
| Молекулярная масса 108,96 г×моль-1 tкип = 38,4°С tпл. = -125,5°С | 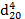 = 1,4555 = 1,4555
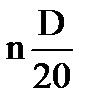 = 1,4239 = 1,4239
|
Растворимость в воде - нормально растворим и органических растворителях ¥ эт, эф, хлф.
Таблица 1 – Свойства основных исходных соединений
| Формула | Молярная масса, г×моль-1 | tпл.°С | tкип°С | 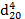
| 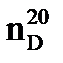
| Растворимость | |
| в воде | в орг. растворит. | ||||||
| С2Н5ОН | 46,069 | -114,1 | 78,4 | 0,7893 | 1,3611 | ¥ | ¥ эф, хлф,мет, укс |
| KBr | 119,002 | 2,75 | - | 65,2 | р. эт, глиц; м.р. эф | ||
| H2SO4 | 98,079 | 10,3 | 279,6 | 1,84 | - | ¥ | реаг. эт |
Глиц – глицерин; мет – метанол; укс – уксусная кислота; хлф – хлороформ; эт – этанол; эф – эфир;
¥ – бесконечно растворим; р. – растворим; м.р. – мало растворимо; реаг. – реагирует.
 2015-10-16
2015-10-16 684
684








