Исследование зависимости скорости ферментативных реакций от концентрации реагирующих веществ стало одним из главных путей изучения механизма действия ферментов. В 1905 году французский исследователь Генри впервые высказал ряд предположений, которые были экспериметально подтверждены в 1913 году Леонором Михаэлисом и Мод Ментен (США, Канада).
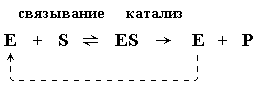
Реакция, катализируемая ферментом, проходит этап образования фермент-субстратного комплекса
- фермент не расходуется во время реакции
- Концентрация фермента намного меньше концентрации субстрата, что ограничивает образование комплекса ЕS.
- Если концентрация субстрата [S] очень низкая, ограничивающим скорость реакции становится этап образования комплекса ES (связывание) и реакция проявляет свойства реакции первого порядка.
Если концентрация субстрата [S] высокая, количество образующегося комплекса ES зависит от количества доступного фермента, и скорость реакции не зависит от концентрации субстрата (реакция нулевого порядка). Ограничивающим скорость реакции становится этап образования продукта (катализ). В реакции, катализируемой ферментом имеется верхний предел скорости реакции, зависящий от максимально возможной концентрации образующегося комплекса ЕS
[ES]max = [Et]общ
Общее количество фермента в системе, равно сумме [E] (концентрация свободного фермента), и [ES] (концентрация фермента, связанного в данный момент времени с субстратом). Ограничение в скорости наступает, когда весь фермент занят.
| [Et]общ | = | [E] + [ES] |
| Общее количество | = | свободный +связанный |
Важным для правильной оценки результатов исследования зависимости скорости реакции от концентрации является измерение начальной скорости реакции.
В 1926 году англичане Бриггс и Холдейн ввели понятие динамического равновесия или стационарного состояния. При взаимодействии фермента и субстрата очень быстро наступает равновесие между скоростью образования и скоростью распада фермент субстратного комплекса. Это предположение дополняло представления Генри, Михаэлиса и Ментен и позволяло более полно охарактеризовать кинетику ферментативных реакций.
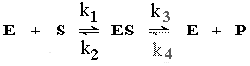
В реакции, катализируемой ферментом можно выделить четыре реакции, каждая из которых характеризуется собственной константой скорости. Однако, учитывая, что используются данные только о начальных скоростях реакции, когда продукт еще не успевает повлиять на ход реакции ([P] = 0) значение k4 можно исключить из расчетов.
 2015-10-16
2015-10-16 1481
1481
