Если мы простроим график зависимости скорости реакции V от концентрации субстрата [S] мы получим кривую типа
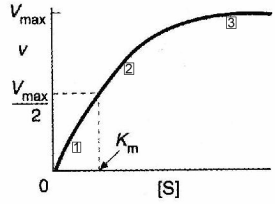 |
Рис 2-6. График зависимости скорости реакции V от концентрации субстрата [S]
При низкой концентрации субстрата (в области [S] < 0.1 Км, обозначено (1), рис 2-6), можно показать что
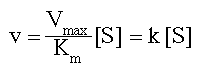
т. е., из уравнения Михаэлиса-Ментен вытекает, что v = k [S]; скорость реакции прямо пропорциональна концентрации субстрата. Это – реакция первого порядка. Такая кинетика свидетельствует, что фермент не насыщается субстратом и некоторые ферменты свободны. Поэтому прибавление большего количества субстрата, приводит к образованию большего количества фермент-субстратного комплекса ES, который, распадаясь, дает большее количество продукта реакции P.
При высокой концентрации субстрата (если [S] > 10 Км, обозначено 3, рис 2-6)
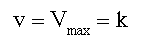
Это значит, что скорость реакция стала независимой от концентрации субстрата. (реакция нулевого порядка), и это можно объяснить тем, что все молекулы фермента насыщены субстратом. Прибавление большего количества субстрата к раствору, не дает прироста ES и, поэтому, скорость не изменяется.
|
|
|
Зависимость в зонах между 1 и 3 на графике носит смешанный характер.
Из изложенного выше вытекает еще один важный вывод: если концентрация субстрата находится в пределах от 0.1 Km до 10 Km, ферменты используются эффективно без утраты контроля со стороны субстрата. В пределах этого диапазона, изменения концентрации субстрата отражаются на изменениях скорости реакции.
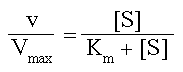 |
Каково физическое значение Km? Уравнение Михаэлиса-Ментен можно преобразовать к такому виду
Из этого уравнения легко показать, что
| при [S] =10Km | v/Vmax = 0.91 |
| при [S] =Km | v/ Vmax = 0.50 |
| при [S] = 0.1Km | v/ Vmax = 0.09 |
Т.е, Km = [S], если скорость реакции равна половине от максимальной скорости и, значит, выражается в единицах концентрации. При условии, что k3 << k2, константа Михаэлиса становится хорошим показателем сродства фермента к субстрату. Чем выше значение Км, т.е., чем выше должна быть концентрация субстрата для достижения Vmax, тем ниже это сродство и наоборот.
Значение Km дает также некоторые представления относительно эффективности катализа и регуляции. Если [S]>> 10 Km, реакция является эффективной («работают» все молекулы фермента), но реакция утрачивает способность к регуляции количеством субстрата. Если [S] << 0.1 Km, эффективность реакции низка, но имеется хорошее управление скоростью реакции путем изменения концентрации субстрата. Наиболее удобное сочетание эффективности и контроля соблюдается при условии, если концентрация субстрата одного порядка со значениями Km. Эти выводы имеют важное прикладное значение. Если Вы отлаживаете исследование фермента или в клинической лаборатории или исследовательской лаборатории, следует насыщать фермент субстратом. Знание Км позволит Вам оценивать концентрацию субстрата, необходимую для гарантии насыщения. Эта концентрация должна быть равна по крайней мере двум Км. В физиологических условиях, для эффективной работы концентрация субстрата должна быть на уровне Км этого фермента, но если важно управление концентрацией субстрата, концентрация субстрата должна быть в диапазоне ниже 5 Км.
|
|
|
Практически рассчитать значения Км и Vmax, пользуясь кривой, описываемой уравнением Михаэлис и Ментен сложно. Более удобно оказалось определять эти параметры в координатах “двойных обратных величин”. Формула уравнения Михаэлиса в этом случае приобретает следующий вид
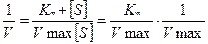
а зависимость - вид прямой линии (график Лайнуивера-Берка).
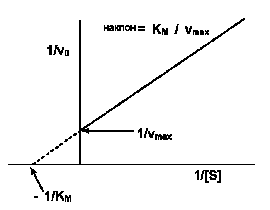
Рис.2-7. График зависимости скорости реакции от концентрации субстрата. Метод «двойных обратных величин» (график Лайнуивера-Берка).
Такой способ выражения позволяет более точно рассчитать значения Км и V. Пересечение линии с осью 1/[S] позволяет вычислить значение Км, а пересечение с осью 1/V – значение максимальной скорости.
 2015-10-16
2015-10-16 1419
1419








