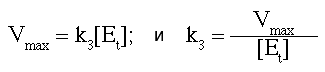 |
Kcat или число оборота. Какпоказано выше, для всех катализируемых ферментами реакций максимальная скорость достигается при полном насыщении ферментов субстратом, тогда [ES] = [Et] и
по этой причине, k3 (которую также называют kcat при полном насыщении субстратом) рассматривают как число оборота, и
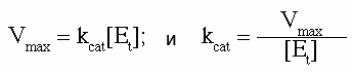 |
| Уравнение 1 |
Число оборотов выражается максимальным числом молекул субстрата, которые могут быть преобразованы в продукт в единицу времени (обычно за секунду) одной молекулой фермента. Эта характеристика фермента связана со значением kcat. kcat включает константы скорости всех реакций между ES и E + P в многошаговом ферментном процессе. Kcat - своеобразная мера образования продукта при оптимальных условиях (насыщенный субстратом фермент ). Единица измерения kcat - сек-1. Величину, обратную kcat можно рассматривать как время, необходимое одной молекуле фермента для превращения одной молекулы субстрата в продукт или альтернативно, kcat отражает число молекул субстрата катализируемых молекулой фермента за секунду т.е. число оборота
|
|
|
Большинство ферментов имеет число оборотов в пределах 1 - 104 сек-1. Каталаза, катализирующая реакцию (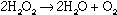 ), имеет одно из самых высоких известных чисел оборота, 1x107. С другой стороны, лизоцим использует две (2) секунды для преобразования молекулы субстрата в продукт.
), имеет одно из самых высоких известных чисел оборота, 1x107. С другой стороны, лизоцим использует две (2) секунды для преобразования молекулы субстрата в продукт.
Если концентрация субстрата [S] низкая, то [E] 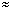 [Et]
[Et]
Поэтому, при низкой концентрации субстрата [S], из уравнения 1 и уравнения Михаэлиса-Ментен вытекает, что если
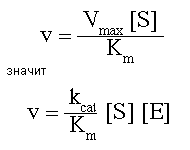
Если теперь взять фермент и два различных субстрата А и B то при одной и той же концентрации фермента в обеих реакциях, можно показать что
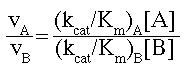
Здесь отношение kcat/KM подобно константе скорости реакции второго порядка для реакции между свободным ферментом и субстратом. Оно важно для оценки взаимодействия фермента и субстрата при условии избытка активных центров связывания субстрата, что позволяет непосредственно сравнивать эффективность действия фермента при взаимодействии с различными субстратами. Следующая таблица показывает значение kcat/KM для различных субстратов химотрипсина. Как видно эффективность фермента к указанным субстратам колеблется в очень широких пределах (для Гли и Фен различия достигают примерно 1 миллиона, объясняя специфичность этого фермента).
| Табл 2-2. Значения kcat/Km для различных субстратов химотрипсина | ||
| Аминокислота в субстрате | Боковая цепь аминокислоты | Kcat/Km[(моль/л)-1сек-1] |
| Глицин | -Н | 1.3х10-1 |
| Валин | -СН2-СН2-СН3 | 3.6х102 |
| Лейцин | -СН2-СН2-СН2-СН3 | 3.0х103 |
| Фенилаланин | -СН2-ФЕНИЛ | 1.0х105 |
Максимально высокое значение kcat/KM, которое определяется частотой столкновений субстрата и фермента, будет зависеть от скорости диффузии реагирующих веществ в растворе. Такого рода реакции называют ограничиваемыми диффузией реакциями. При условии, что каждое столкновение приводит к образованию фермент-субстратного комплекса, диффузионная теория предсказывает, что верхний предел kcat/KM, как проявление высшего совершенства ферментативной реакции, может достигать значений порядка 108 - 109 (моль/л)-1 сек-1. Субстрат не может перемещаться к ферменту быстрее. Такие ферменты как карбангидраза, фумараза и триозофосфатизомераза фактически приближаются к этому пределу. Их каталитическая скорость ограничена только скоростью, с которой они сталкиваются с субстратом в растворе. Любое дальнейшее увеличение в скорости может быть достигнуто только при условии уменьшения времени диффузии. Действительно, многие ферменты в клетке связаны в организованные ансамбли, в которых продукт одного фермента очень быстро находится следующим ферментом. Фактически, продукт переходит от одного фермента к другому подобно конвейерной линии.
|
|
|
Ниже приводятся серия значений Км,kcat и kcat/Km, которые позволят представить диапазоны этих величин.
. Значения Км, kcat и отношение Кcat/Км показаны в табл 2-3.
Табл 2-3. Значения Км, kcat и отношение Кcat/Км для разных ферментов.
| Фермент | Субстрат | Км (М/л) | kcat (сек-1) | Kcat/Km (М/л)-1 сек-1 |
| Ацетилхолинэстераза | Ацетилхоллин | 9.5х10-5 | 1.4х104 | 1.5х108 |
| Карбангидраза | СО2 | 1.2 х 10-2 | 1.0х106 | 8.3х107 |
| НСО3 | 2.6 х10-2 | 4 х105 | 1.5 х107 | |
| Каталаза | Н2О2 | 2.5х102 | 1.0х107 | 4.0х108 |
| Химотрипсин | Этиловый эфир N-ацетилГли | 4.4х10-1 | 5.1х10-2 | 1.2х10-1 |
| Этиловый эфир N-ацетилВал | 8.8х10-2 | 1.7х10-1 | 1.9 | |
| Этиловый эфир N-ацетилТир | 6.6х10-4 | 1.9х102 | 2.9х105 | |
| Фумараза | Фумарат | 5 х10-6 | 8 х102 | 1.6 х108 |
| Малат | 2.5 х10-5 | 9.0 х102 | 3.6 х107 | |
| Рибонуклеаза | РНК | 7.9 х10-3 | 7.9х102 | 1.0 х105 |
 2015-10-16
2015-10-16 3188
3188
