А. Ферменты увеличивают p и Z, устраняя случайность во взаимодействии молекул.
- 
- Эффект ориентации. Уже начиная с самого первого шага ферментативной реакции - приближения субстрата к ферменту (в основе которого лежат законы диффузии), способствующие группы активного центра обеспечивают сближение реагирующих молекул в правильной ориентации, необходимой для связывания с контактными группами и проведения реакции.
Эффект сближения. ферменты связывают свои субстраты, так что реактивные группы субстратов сближаются на расстояния, необходимые для проведения реакции и удерживаются в таком положении до окончания реакции. Атакуемые группы субстратов при этом оказываются расположенными в непосредственной близости от каталитической группы и правильно ориентированной по отношению к ней, что обеспечивает образование переходного состояния.
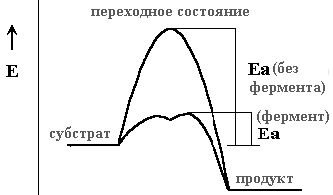 Стабилизация переходного состояния: Все реакции проходят через переходное состояние, которое представляет энергетический максимум реакции; Ea - это энергия, необходимая для достижения переходного состояния. Ферменты могут проводить реакции по путям с более низким энергетическим барьером.
Стабилизация переходного состояния: Все реакции проходят через переходное состояние, которое представляет энергетический максимум реакции; Ea - это энергия, необходимая для достижения переходного состояния. Ферменты могут проводить реакции по путям с более низким энергетическим барьером.
Одним из таких путей может быть напряжение и деформацияатакуемойферментом связи, возникающее в силу индуцированного соответствия между молекулами фермента и субстрата. Присоединение субстрата вызывает конформационные изменения молекулы фермента в области активного центра и деформацию субстрата, обеспечивая вынужденное индуцируемое соответствие между ними. Это является своеобразным объяснением необходимости больших размеров молекул ферментов. Энергия перестройки групп и связей в фермент-субстратном комплексе во время индуцированного взаимодействия может быть своеобразной формой накопления энергии, реализуемой затем в механизме катализа.
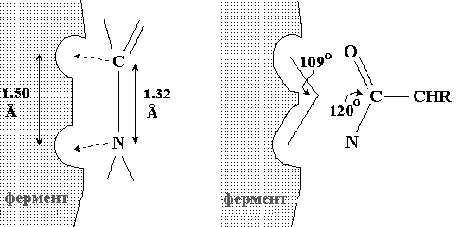
Приведенные выше особенности работы фермента оказывают влияние на энтропийную составляющую изменений свободной энергии реакции. Расчеты показывают, что эффекты сближения и ориентации, вызываемые ферментом при взаимодействии с субстратом, могут быть основой 105 кратного ускорения реакции каждый по сравнению со скоростью некатализируемой самопроизвольной реакции.
 2015-10-16
2015-10-16 432
432








