Для изолированных систем понятие энтропии позволяет отличать обратимые процессы от необратимых.
В формулировке немецкого физика Рудольфа Клаузиуса: в изолированной системе самопроизвольно могут протекать только процессы, которые ведут к увеличению энтропии
Австрийский физик Л. Больцман определил, что макросостоянию соответствуют определенные микросостояния системы.
Статистический вес (W) – число различных микросостояний, соответствующих данному макросостоянию.
Логарифм - W: S = k\nW, определяющий связь между энтропией и термодинамической вероятностью, где k – коэффициент пропорциональности Больцмана.
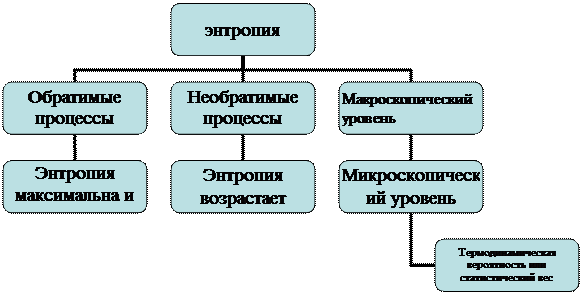
Согласно Больцману следует, что второй закон термодинамики – следствие статистических законов поведения большой совокупности частиц.
Это означает, что необратимое возрастание энтропии в изолированной системе следует рассматривать как проявление увеличивающегося хаоса.
Известно, что асимметрия приводит к уменьшению числа способов, которыми осуществлено данное макросостояние – уменьшение термодинамической вероятности ( W).
Любая изолированная система самопроизвольно эволюционирует в направлении забывания начальных условий, т.е. к состоянию хаоса и максимальной симметрии. Все в природе стремится к равновесию. Тепловое равновесие – максимум энтропии.
По словам У. Эддингтона, возрастание энтропии, определяющее необратимые процессы, есть стрела времени.
«Энтропия изолированной системы при протекании необратимых процессов возрастает, ибо система, представленная самой себе, переходит из менее вероятного состояния в более вероятное. Энтропия системы, находящейся в равновесном состоянии, максимальна и постоянна. ∆ S ≥ O»
 2015-10-16
2015-10-16 929
929








