1. Влияние на равновесие изменения концентраций реагирующих веществ.
Смешивают в пробирках растворы (разбавленные) FeCl3 и NH4NCS в равных объемах. В растворе в равновесии находятся четыре вещества:
FeCI3 + 3NH4NCS 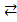 Fe(NCS)3 + 3NH4CI,
Fe(NCS)3 + 3NH4CI,
одно из которых Fe(NCS)3 окрашено в темно-красный цвет. По интенсивности окрашивания раствора, пропорциональной концентрации Fe(NCS)3 можно судить о смещении равновесия. Полученный раствор делят на четыре порции в четыре пробирки. В одну добавляют несколько капель концентрированного раствора FeCl3, в другую — несколько капель концентрированного раствора NH4NCS. В третью пробирку добавляют несколько капель концентрированного раствора NH4Cl. Четвертая пробирка остается в качестве контрольной. Результаты наблюдений запишите в таблицу 1, отметив изменение окраски раствора и указав стрелкой направление химической реакции.
Таблица 1
| № пробирки | Добавленное вещество | Изменение окраски раствора | Направление cмещения равновесия |
Напишите выражение для константы химического равновесия и объясните смещение равновесия в соответствии с принципом Ле Шателье.
2. Смещение ионного равновесия.
В разбавленных растворах слабых электролитов устанавливается равновесие:
AB 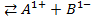
Константа равновесия 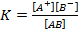 называется константой диссоциации.
называется константой диссоциации.
а) К разбавленному раствору гидроксида аммония добавить одну каплю раствора фенолфталеина. Малиновая окраска указывает на значительную концентрацию гидроксильных ионов. Прибавить в пробирку концентрированный раствор хлорида аммония. Почему исчезает окраска раствора?
б) К разбавленному раствору уксусной кислоты СН3СООН добавить 1—2 капли лакмуса и затем щепотку кристаллической соли — ацетата натрия (CH3COONa). Встряхивая раствор, добиться наиболее полного растворения соли. Объяснить изменение окраски раствора. Как изменится степень диссоциации уксусной кислоты в присутствии ацетата натрия?
Результаты опытов «а» и «б» записать в таблицу 2, указав стрелкой смещение ионного равновесия.
Таблица 2
| № п/п | Электролит | Индика-тор | Окраска раствора | Добавлен- ное веще- ство | Измене- ние ок- раски раст- вора | Направ- ление сме-щения равнове- сия |
| NH4OH | Фенол-фталеин | Малино- вая | NH4CI | |||
| СНзСООH | Лакмус | Красная | CH3COONa |
Написать константы равновесия для ионных процессов:
NH4OH 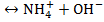
CH3COOH 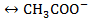 +
+ 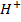
3. Влияние температуры на равновесие (учебно-исследовательская работа).
При взаимодействии иода с водным раствором крахмала образуется вещество сложного состава (иодокрахмал),
которое окрашивает раствор в синий цвет. Реакция обратима и может быть представлена следующей схемой:
иод+крахмал 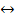 иодокрахмал.
иодокрахмал.
Синяя окраска исчезает при нагревании, что свидетельствует о смещении положения равновесия данной реакции.
Налить в пробирку 8—10 мл раствора крахмала, добавить 3—5 капель йодной воды. Полученный синий раствор разделить на две порции в две пробирки, оставив одну из них в качестве контрольной.
а) Нагреть синий раствор на водяной бане до полного обесцвечивания. В каком направлении смещается равновесие при нагревании?
б) Охладить пробирку с раствором под струей холодной воды из-под крана. Что наблюдается? В каком направлении смещается равновесие данной реакции при охлаждении?
Какая из реакций (прямая или обратная) является экзотермической, а какая эндотермической? Согласуются ли ваши наблюдения относительно смещения равновесия с принципом Ле Шателье?
 2015-10-16
2015-10-16 745
745







