Проведите реакции и заполните следующую таблицу, используя эталон выполнения задания:
| Методика выполнения эксперимента | Уравнения реакций | Наблюдения и выводы |
| 5.1. Реакции идентификации катиона алюминия | ||
1. Осаждение раствором гидроксида аммония
К 2 каплям раствора соли алюминия добавляют 3 капли 2 моль/л раствора гидроксида аммония и нагревают 5 минут на водяной бане. Выпадает белый аморфный осадок гидроксида алюминия
Полученный осадок делят на две части. К части осадка добавляют по каплям раствор соляной кислоты до растворения осадка. Ко второй части осадка добавляют по каплям раствор гидроксида натрия до растворения осадка. Амфотерный гидроксид алюминия растворяется при рН не менее 4,5 и рН более 10,0.
К полученному раствору алюмината прибавляют кристаллический хлорид аммония и нагревают до кипения – вновь выпадает осадок гидроксида алюминия
Добавляя хлорид аммония – соль, гидролизующуюся по катиону (NH 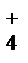 + H2O=NH4OH + H+), снижают величину рН раствора до 7-8, которая поддерживается постоянной благодаря образованию аммиачной буферной смеси.
Реакцию используют для отделения и обнаружения в присутствии Zn2+; Cr3+; Mn2+; Fe3+ и других катионов. + H2O=NH4OH + H+), снижают величину рН раствора до 7-8, которая поддерживается постоянной благодаря образованию аммиачной буферной смеси.
Реакцию используют для отделения и обнаружения в присутствии Zn2+; Cr3+; Mn2+; Fe3+ и других катионов.
| ||
| 2. * Реакция с ализарином (капельный вариант) На фильтровальную бумагу наносят каплю растворимой соли алюминия. Пятно обрабатывают парами аммиака, держа бумагу над отверстием склянки с концентрированным раствором аммиака. Пятно смачивают раствором ализарина и вновь обрабатывают парами NH3 – появляется розовое пятно ализариналюминиевого лака на фиолетовом фоне. При подсушивании бумаги фиолетовый фон (продукт взаимодействия ализарина с аммиаком) переходит в желтый. В описанных условиях ализариновые лаки также образуют ионы Fe3+; Cr3+; Sn2+; Mn2+; Zn2+; Cu2+ и другие. Мешающие катионы маскируют связыванием в малорастворимые гексацианоферраты, обрабатывая фильтровальную бумагу K4[Fe(CN)6]. Реакция может быть использована для дробного обнаружения иона алюминия в предварительных испытаниях | ||
| 3. Фармакопейная реакция с нитратом кобальта (II) (пирохимический способ) На полоску фильтровальной бумаги помещают последовательно по 1-2 капли солей алюминия и нитрата кобальта (II). После подсушивания и сжигания бумаги образуется пепел синего цвета состава Co(AlO2)2 – «тенарова синь». К мешающим ионам относятся ионы Zn2+, образующие пепел зеленого цвета. | ||
| 5.2. Реакции идентификации катиона цинка | ||
| 1. Осаждение раствором гидроксида аммония К 3-4 каплям раствора соли цинка добавляют 1-2 капли 2 моль/л раствора гидроксида аммония. Выпадает белый осадок гидроксида цинка, растворяющегося в избытке реагента с образованием бесцветного раствора, содержащего ионы тетраамминцинка. Реакцию используют для отделения Zn2+ от других катионов IV группы. | ||
2. Фармакопейная реакция образования сульфида цинка
К 3-4 каплям раствора соли цинка прибавляют 2-3 капли раствора ацетата натрия и 5 капель сероводородной воды – образуется белый осадок сульфида цинка
Сульфид цинка растворяется в минеральных кислотах, но не растворяется в уксусной кислоте (осаждение проводят 2 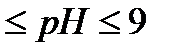 ). Добавление ацетата натрия, гидролизирующегося по аниону (CH3COO– + + H2O = CH3COOH + OH–), способствует повышению рН и делает возможным открытие Zn2+ в присутствии других катионов IV группы. ). Добавление ацетата натрия, гидролизирующегося по аниону (CH3COO– + + H2O = CH3COOH + OH–), способствует повышению рН и делает возможным открытие Zn2+ в присутствии других катионов IV группы.
| ||
| 3. Фармакопейная реакция с гексацианоферратом (II) калия К 3-4 каплям раствора соли цинка прибавляют 2-3 капли раствора гексацианоферрата (II) калия – образуется белый осадок калия-цинка гексацианоферрата (II); растворимый в щелочах и нерастворимый в разбавленной соляной кислоте, поэтому реакцию следует проводить при рН 7. К мешающим ионам относятся Ag+; Ca2+; Cd2+; Cu2+; Fe3+ и другие катионы (кроме Al3+ и Cr3+), а также ионы-окислители, окисляющие [Fe(CN)6]4– до [Fe(CN)6]3–. | ||
| 4. Микрокристаллоскопическая реакция образования тетратиоцианатомеркурата (II) К капле раствора соли цинка на предметном стекле прибавляют каплю раствора уксусной кислоты и по капле растворов соли ртути (II) и тиоцианата аммония. Под микроскопом бесцветные кристаллы имеют форму характерных крестов, дендритов и вытянутых треугольников. К мешающим ионам относятся Cu2+; Fe2+; Ni2+; Cd2+; Co2+; Fe3+. Реакцию проводят в слабокислой среде, поскольку осадок Zn[Hg(SCN)4] растворим в кислотах и щелочах. | ||
| 5. Реакция с дитизоном К 2-3 каплям раствора соли цинка прибавляют 3-4 капли ацетатного буфера (рН 4,5) и 6-7 капель хлороформного раствора дитизона. Содержимое пробирки встряхивают – хлороформный слой окрашивается в ярко-красный цвет: Реакция применяется для дробного обнаружение Zn2+ в присутствии других ионов. В экстракционном варианте мешающее влияние Cd2+; Sn2+; Ag+; Bi3+; Pb2+; Cu2+ и др. устраняется добавлением 3-4 капель тиосульфата натрия. После обработки тиосульфатом раствор центрифугируют и добавляют раствор дитизона в хлороформе. Появление малиново-красного окрашивания водного и хлороформного слоя свидетельствует о наличии Zn2+. | ||
| 6. Реакция с нитратом кобальта (II) (пирохимический способ) Смачивают полоску фильтровальной бумаги раствором соли цинка и соли Co(NO3)2, высушивают и сжигают. Образуется пепел зеленого цвета вследствие образования цинката кобальта – «ринманова зелень». В аналогичных условиях соли алюминия образуют пепел синего цвета. | ||
| 5.3. Реакции идентификации катионов хрома (III). | ||
1. Реакция с растворами едких щелочей
К 2-3 каплям раствора соли хрома (III) добавляют 1-2 капли 2 моль/л раствора гидроксида натрия. Выпадает осадок гидроксида хрома (III) серо-зеленого цвета
Полученный осадок делят на две части. К части осадка добавляют по каплям раствор соляной кислоты до растворения осадка. Ко второй части осадка добавляют по каплям раствор гидроксида натрия до растворения осадка.
Осаждение Cr3+ в виде Cr(OH)3 (рН полного осаждения 6.8) достигается под действием растворов аммиака, аммиачного буферного раствора (рН 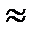 8-10), Na2CO3; (NH4)2S. 8-10), Na2CO3; (NH4)2S.
| ||
2. Реакция окисления в щелочной среде с последующим обнаружением CrO 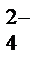 и Cr2O и Cr2O 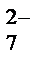 - ионов К 2-3 каплям раствора соли хрома (III) добавляют по каплям 2 моль/л раствор щелочи NaOH или KOH до образования осадка и далее до его растворения. К содержимому пробирки добавляют 6-8 капель 3 % раствора H2O2 и нагревают до перехода зеленой окраски в желтую. После охлаждения добавляют 2 моль/л раствор H2SO4 до перехода желтого окрашивания в оранжевое. Реакция окисления Cr3+ пероксидом водорода специфична и позволяет дробно обнаружить Cr3+ в присутствии других катионов. - ионов К 2-3 каплям раствора соли хрома (III) добавляют по каплям 2 моль/л раствор щелочи NaOH или KOH до образования осадка и далее до его растворения. К содержимому пробирки добавляют 6-8 капель 3 % раствора H2O2 и нагревают до перехода зеленой окраски в желтую. После охлаждения добавляют 2 моль/л раствор H2SO4 до перехода желтого окрашивания в оранжевое. Реакция окисления Cr3+ пероксидом водорода специфична и позволяет дробно обнаружить Cr3+ в присутствии других катионов.
| ||
| 3.* Реакция образования надхромовой кислоты (экстракционный способ) К 2-3 каплям раствора дихромат-ионов добавляют 2-3 капли пероксида водорода, 0,5 мл изоамилового спирта или его смеси с диэтиловым эфиром и разбавленной серной кислотой до кислой реакции. Содержимое пробирки встряхивают, органический слой окрашивается в синий цвет за счет образования надхромовой кислоты. |
 2015-10-13
2015-10-13 479
479








