Алкены (олефины) – это углеводороды, в молекулах которых содержатся атомы углерода, соединенные между собой двойной связью (непредельные углеводороды ряда этилена). Простейший представитель – этилен С2Н4, общая формула гомологического ряда этиленовых углеводородов СnН2n (при п ≥ 2).
Систематические названия олефинов производятся от корней названий алканов с заменой суффикса – ан → – ен:

Сохраняются также традиционные названия с заменой суффикса – ан на – илен: С2Н4 – этилен, С3Н6 – пропилен, С4Н8 – бутилен; использование названия амилен для алкена С5Н10 не рекомендуется.
Положение двойной связи С=С в изомерах строения (начиная с алкена С4) указывается цифрой после названия:
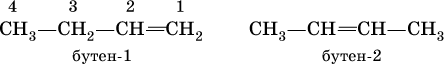
Радикал этилена – этенил СН2=СН – обычно называют винил, пропена – пропенил СН2=СН – СН2 – именуют аллил.
Другой вид изомерии в непредельных углеводородах, помимо структурной изомерии, осуществляется потому, что атомы углерода, образующие двойную связь, находятся в sр2‑гибридном состоянии; σ‑составляющая двойной связи С=С и σ‑связи С – Н лежат в одной плоскости под углом 120° друг к другу, а π‑составляющая двойной связи С=С представляет собой электронное облако, вытянутое в направлении, перпендикулярном плоскости о‑связей. Следствием такого строения алкенов является возможность геометрической изомерии (или цис‑транс‑изомерии) в зависимости от положения заместителей (атомов или радикалов):
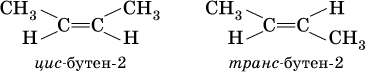
(цис – от лат. «рядом, по одну сторону», транс – от лат. «напротив, по разные стороны»).
Алкены С2–С4 при комнатной температуре – бесцветные газы со слабым запахом нефти, малорастворимые в воде; алкены С5–C18 – жидкости, алкены C19 и выше – твердые вещества.
Важнейшие химические свойства алкенов определяются тем, что в силу меньшей прочности π‑связи (по сравнению с σ‑связью) она легко разрывается, в результате чего протекают реакции присоединения и образуются насыщенные органические соединения. Как правило, такие реакции идут в мягких условиях, часто на холоду и в растворителях, например воде, тетрахлорметане СCl4 и др.:
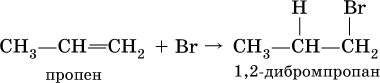
Аналогично протекает взаимодействие алкенов с бромоводородом:

Присоединение галогеноводородов к несимметричным алкенам теоретически может привести к двум продуктам:
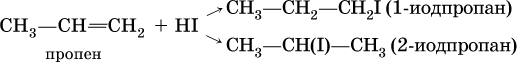
Согласно правилу Марковникова, присоединение галогеноводородов к несимметричным алкенам протекает так, что водород направляется к атому углерода, который уже содержит большее число атомов водорода. В приведенной выше реакции продуктом будет 2‑иодпропан СН3СН(I)СН3.
По правилу Марковникова протекает и реакция гидратации, т. е. реакция присоединения воды в присутствии серной кислоты. Она происходит в две стадии:
а) вначале образуется алкилсерная кислота, т. е. H2SO4 присоединяется к алкену:
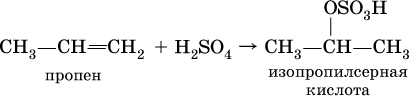
б) затем происходит ее необратимый гидролиз:
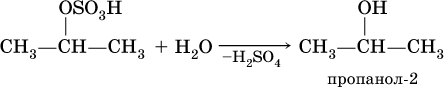
Алкены обесцвечивают раствор перманганата калия на холоду в нейтральной среде, при этом образуются гликоли (двухатомные спирты):
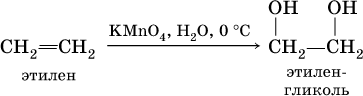
Алкены способны вступать в реакции полимеризации:
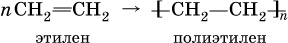
Качественные реакции на алкены – обесцвечивание бромной воды и раствора КMnO4 (уравнения реакций см. выше).
Алкадиены – непредельные углеводороды, в молекулах которых содержатся две связи С=С. Общая формула алкадиенов СnН2n‑2 (n ≥ 3), формула совпадает с таковой для алкинов.
Примеры:
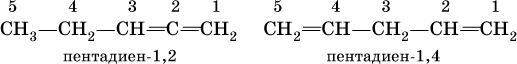
Большое практическое значение имеют сопряженные диены, в молекулах которых связи С=С разделены одинарной связью С – С:
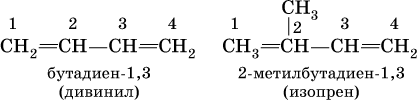
Дивинил и изопрен – традиционные названия.
Дивинил – бесцветный, легко сжижающийся (при ‑4,5 °C) газ, изопрен – низкокипящая (34,1 °C) жидкость.
Алкадиены вступают в те же реакции присоединения, что и алкены. Сопряженные диены имеют особые свойства, в частности, в реакциях присоединения; они образуют продукты 1,4‑присоединения с одной двойной связью посредине:
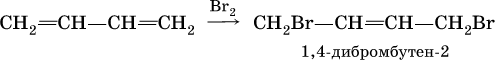
(далее возможно образование 1, 2, 3, 4‑тетрабромбутана).
Алкадиены способны полимеризоваться с образованием каучуков:
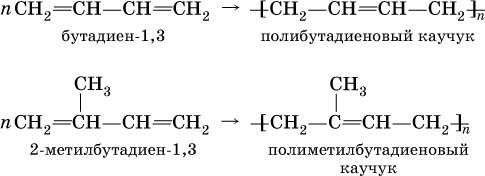
Полиметилбутадиеновый каучук – это полимер, существующий в природе (натуральный каучук), а полибутадиеновый каучук получен искусственно (С. В. Лебедев, 1932 г.) и называется синтетическим каучуком.
Получение: для алкенов в промышленности используют метод каталитического дегидрирования алканов:
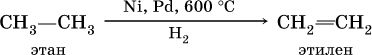
В лаборатории алкены получают:
1) дегидратацией спиртов (отщепление воды от спиртов):
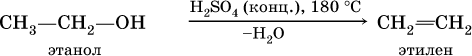
2) дегидрогалогенированиеж – отщеплением галогеноводорода от моногалогенопроизводного под действием спиртового раствора щелочи:
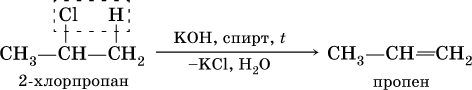
3) дегалогенированиеж – отщеплением галогенов от дигалогенопроизводных, в которых атомы галогена находятся у соседних атомов углерода:
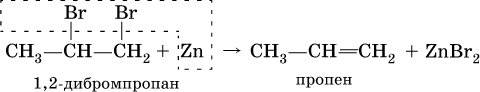
Промышленное получение дивинила:
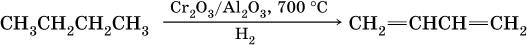
2) способ Лебедева – одновременное отщепление воды и водорода от этанола на катализаторе (ZnO/Al2O3):
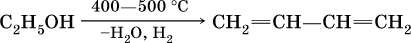
Алкены используются для органического синтеза, производства пластмасс, искусственного моторного топлива, диеновые углеводороды – исходное сырье в промышленном синтезе каучуков.
Алкины
Алкины – углеводороды с тройной связью C≡C в молекулах (непредельные углеводороды ряда ацетилена). Простейший представитель этого ряда – ацетилен С2Н2, общая формула алкинов CnH2n‑2 (при n ≥ 2).
Названия простейших алкинов:
С2Н2 – этин (традиционно: ацетилен)
С3Н4 – пропин (метилацетилен)
С4Н6 – бутин
Изомеры бутина:
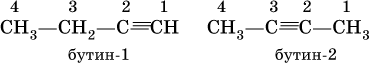
Ацетилен, пропин и бутин‑1 – бесцветные газы при комнатной температуре, бутин‑2 – легкокипящая жидкость, обладает легким «эфирным» запахом.
В алкинах атомные орбитали углерода у тройной связи имеют sp‑ гибридизацию (линейное строение). Наличие двух π‑связей обусловливает их химические свойства, в частности высокую способность к реакциям ступенчатого присоединения водорода, хлора, брома, галогеноводородов, воды:
а)
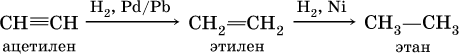
б)
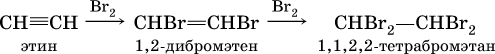
в)
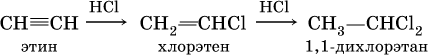
(присоединение НCl к хлорэтену происходит по правилу Марковникова; хлорэтен традиционно называют хлорвинилом или винилхлоридом);
г) реакция Кучерова (гидратация на катализаторе)
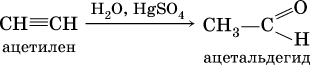
При циклизации ацетилена образуется бензол:
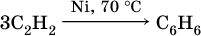
Упомянутый выше хлорвинил способен полимеризоваться:
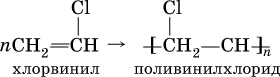
Поливинилхлорид (ПВХ) – полимер, основа пластмассы, волокон и пленок, применяется в производстве труб, искусственной кожи, электроизоляции, пеноматериалов.
1) на алкины любого строения – обесцвечивание раствора КMnO4, чаще всего происходит разрыв углеродной цепи по месту тройной связи (ср. с алкенами);
2) на алкины с концевой тройной связью – замещение концевого атома водорода на медь (I) с образованием ярко‑красного осадка:
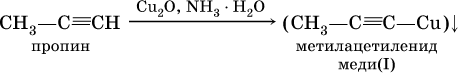
Получение: в промышленности ацетилен ранее получали гидролизом дикарбида (ацетиленида) кальция:
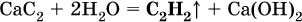
(неприятный «карбидный» запах газа обусловлен примесями, главным образом фосфином РН3).
Современный способ – пиролиз (термическое разложение) метана:
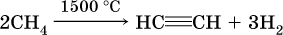
В лаборатории для получения ацетилена и его гомологов используют взаимодействие дигалогенопроизводных алканов со щелочами в спиртовом растворе при нагревании:
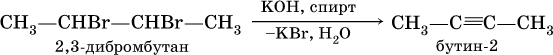
(обязательное условие – атомы галогенов должны находиться при соседних атомах углерода). Эта реакция может проходить в одну стадию (как показано выше), но чаще – в две стадии:
а)
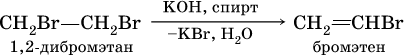
б)
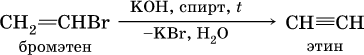
Алкины, особенно ацетилен, используются как исходное сырье в химической промышленности для многих органических синтезов. Кроме того, ацетилен благодаря высокой теплотворной способности сгорания:
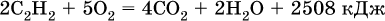
применяется для автогенной сварки и резки металлов.
Арены
Арены – это непредельные углеводороды, которые можно рассматривать как производные простейшего из них – бензола С6Н6. Общая формула углеводородов гомологического ряда бензола СnН2n‑6 (при n ≥ 6).
В молекуле бензола все атомы углерода находятся в sр2‑гибридизации, каждый атом углерода соединен в одной плоскости σ‑связями с двумя другими атомами углерода и одним атомом водорода. У атома углерода остается еще облако четвертого валентного электрона, расположенное перпендикулярно плоскости. Эти облака участвуют в образовании π‑связи, причем в молекуле образуются не три отдельные π‑связи (как думали раньше, см. формулу Кекуле, 1865 г.), а единая шестицентровая (С6) π‑связь (все атомы равноценны):
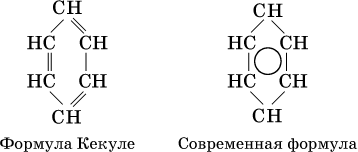
Формула Кекуле часто применяется в тех случаях, когда необходимо более наглядно представить протекание реакции с участием бензольного кольца С6; его изображение:
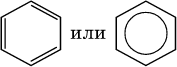
В обеих формулах атомы С кольца и не участвующие в реакции атомы Н опускаются (для краткости). Некоторые простейшие гомологи бензола:
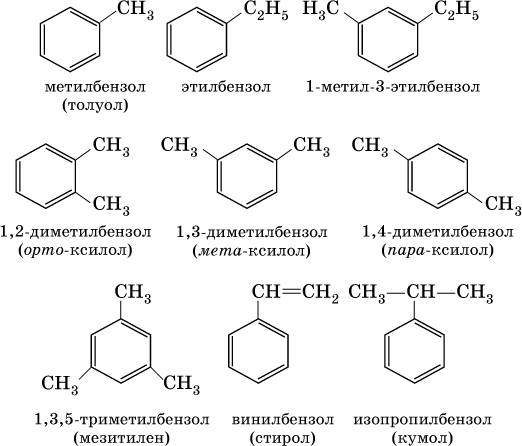
Радикал бензола С6Н5 называется фенил, радикал толуола С6Н5СН2 – бензил.
Бензол и его ближайшие гомологи – жидкости без цвета, но с характерным запахом, имеют широкий интервал жидкого состояния. Практически не растворяются в воде, но хорошо смешиваются между собой и с другими органическими растворителями. Пар бензола сильно ядовит.
Несмотря на формальную непредельность, бензол отличается высокой устойчивостью к нагреванию и окислению (в гомологах бензола окисляется только боковая цепь). Характерными для бензола являются реакции замещения:
а) нитрование в присутствии концентрированной серной кислоты на холоду:
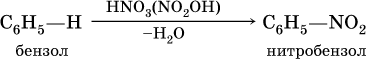
б) галогенирование в присутствии галогенидов железа (III):
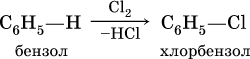
в) алкилирование в присутствии хлорида алюминия:
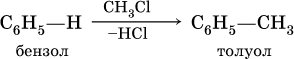
Особый характер ненасыщенности бензола и его гомологов иллюстрируется этими химическими свойствами и называется «ароматическим» характером.
В производных бензола атом или группа, заместившие водород кольца, и само бензольное кольцо влияют друг на друга. По характеру влияния различают:
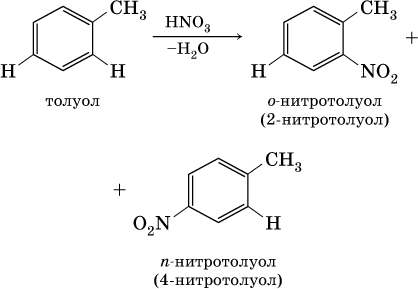
1) заместители I рода – CI, Br, I, СН3, СnН2n+1, ОН и NH2. Они облегчают реакции дальнейшего замещения и направляют второй заместитель по отношению к себе в орто‑ (о‑, или 2‑) положение и в пара‑ (п ‑, или 4‑) положение [для запоминания: о рто – о коло, п ара – п ротив], например:
2) заместители II рода – NO2, С(Н)O, СООН и CN. Они затрудняют реакции дальнейшего замещения и направляют второй заместитель в мета‑ (м ‑, или 3‑) положение, например:
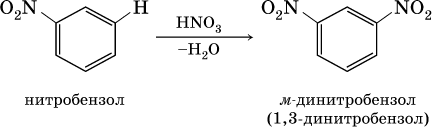
Очевидно, что существуют два орто‑ положения рядом с первым заместителем X, два мета ‑положения, отделенные от первого заместителя одним углеродом кольца, и лишь одно пара ‑положение через два атома углерода бензольного кольца:
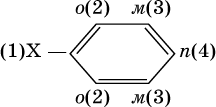
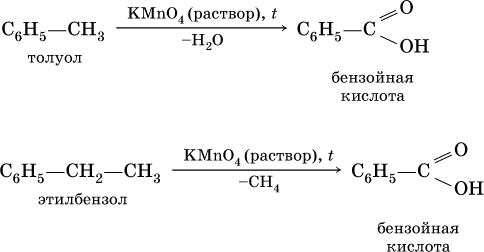
Ранее уже отмечалось, что бензол стоек к окислению даже при действии сильных окислителей. Гомологи бензола с одним боковым радикалом вступают в реакции окисления только за счет радикала; при этом, какова бы ни была его длина, отщепляется вся цепь, кроме ближайшего к кольцу атома углерода (он создает карбоксильную группу):
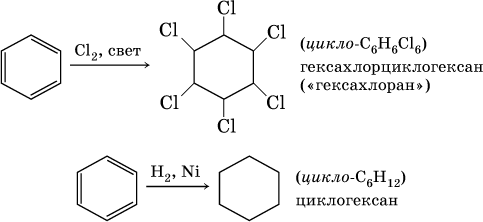
В жестких условиях бензол вступает в реакции присоединения:
Стирол C6H5–CH=CH2, как этилен, легко полимеризуется:
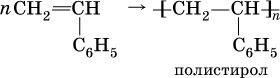
Полистирол – термопластичная пластмасса (термопласт), прозрачный материал, размягчающийся при температуре выше 80 °C. Используется для изготовления изоляции электропроводов, посуды разового употребления, упаковочной массы (пенопласт).
Получение аренов – ароматизация алифатических и алициклических углеводородов, содержащихся в нефтяных или буроугольных бензиновых фракциях:
1) дегидрирование:
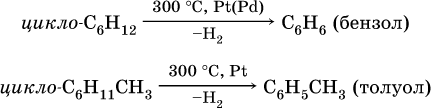
2) дегидроциклизация:
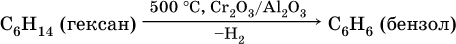
3) тримеризация ацетилена (устаревший способ):
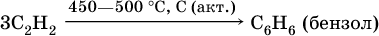
Бензол и его гомологи используются в качестве малополярных растворителей (для каучука, лаковых смол, полимеров), сырье в органическом синтезе.
 2015-10-13
2015-10-13 10394
10394








