Электролизом называется окислительно‑восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через растворы или расплавы электролитов.
На отрицательно заряженном электроде – катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на положительно заряженном электроде – аноде идет электрохимическое окисление частиц (атомов, молекул, анионов).
Примеры электролиза расплавов:
а)
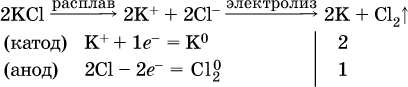
б)
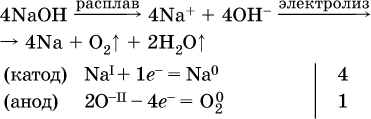
Электролиз воды проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита – воды):
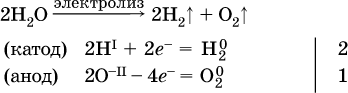
В зависимости от инертного электролита электролиз проводится в нейтральной, кислотной или щелочной среде (например, в присутствии K2SO4, H2SO4 или КОН).
При выборе инертного электролита необходимо учесть, что никогда не восстанавливаются на катоде в водном растворе катионы металлов, являющихся типичными восстановителями (например, Li+, К+, Са2+, Na+, Mg2+, Al3+), и никогда не окисляется на аноде кислород О‑II анионов оксокислот с элементом в высшей степени окисления (например, ClO4‑, SO42‑, NO3‑, РО43‑, CO32‑); вместо них окисляется вода.
Примеры электролиза растворов солей:
а)
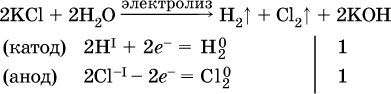
(на аноде окисляются анионы Cl‑, а не кислород О‑II молекул Н2O, так как электроотрицательность хлора меньше, чем у кислорода, и следовательно, хлор отдает электроны легче, чем кислород);
б)
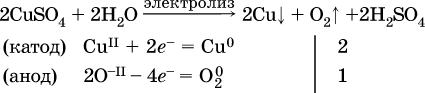
(на катоде восстанавливаются катионы Cu2+, а не водород НI молекул Н2O, так как медь стоит правее водорода в ряду напряжений, т. е. легче принимает электроны, чем НI в воде; подробнее см. 5.3).
Подчеркнем еще раз, что электролиз – это окислительно‑восстановительная реакция, которая протекает под действием и при участии электрического тока. Уравнения электрохимических реакций отражают те процессы, которые без помощи электрического тока протекать не могут.
 2015-10-13
2015-10-13 811
811








