1. Состав атома. Модель строения атома.
2. Состояние электронов в атоме.
3. Строение электронных оболочек атомов 1-4 периодов.
4. Зависимость свойств элементов от электронной конфигурации. Электроотрицательность. Металлические и неметаллические свойства.
Атом – мельчайшая химически неделимая частица, но эта частица имеет сложное строение. В 1911 г. Резерфордом была предложена планетарная модель строения атома. Чуть позже – в 1913 г теория Бора. Суть их теорий можно сформулировать так:
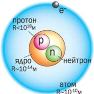 В центре атома находится положительное ядро, занимающее ничтожную часть пространства атома. Вокруг ядра двигаются электроны, они образуют т.н. электронную оболочку. Их общий заряд равен заряду ядра атома, но с противоположным знаком. Разные виды атомов с определенным массовым числом и определенным порядковым номером называют нуклидами.
В центре атома находится положительное ядро, занимающее ничтожную часть пространства атома. Вокруг ядра двигаются электроны, они образуют т.н. электронную оболочку. Их общий заряд равен заряду ядра атома, но с противоположным знаком. Разные виды атомов с определенным массовым числом и определенным порядковым номером называют нуклидами.
Ядро состоит из протонов и нейтронов. В ядре сосредоточена почти вся масса атома (масса протона  1 а.е.м., масса нейтрона
1 а.е.м., масса нейтрона  1 а.е.м., масса электрона = 1/1823 а.е.м.). Число протонов называют протонным числом атома. Совокупность атомов с одинаковым числом протонов называют химическим элементом. Протонное число совпадает с порядковым номером элемента в ПС. Ядро заряжено положительно, а т.к. заряд протона = +1, нейтрона = 0, заряд ядра определяется числом протонов и равен тоже порядковому номеру элемента. Сумма протонов и нейтронов называется массовым числом элемента, потому что именно сумма протонов и нейтронов определяет массу атома. Протоны и нейтроны иногда называют нуклонами, а массовое число нуклонным. Порядковый номер (протонное число) и массовое число – важнейшие характеристики атома. Их указывают около знака химического элемента, например: 2311Na. Если у атомов одинаковое число протонов, но разное число нейтронов, такую совокупность атомов называют изотопами. Это разновидности химического элемента. Они имеют одинаковые химические свойства. Например: 126С и 136С. Иногда с другой стороны от знака химического элемента записывают число нейтронов, т.е. для 126С - 126С6, а для 136С - 136С7. Различают стабильные и радиоактивные изотопы. Зная массовую долю всех изотопов химического элемента и их массовое число мы можем вычислить среднюю атомную массу элемента. Т.к. заряд ядра равен заряду электронной оболочки, а у каждого электрона заряд (-1), то число протонов равно числу электронов.
1 а.е.м., масса электрона = 1/1823 а.е.м.). Число протонов называют протонным числом атома. Совокупность атомов с одинаковым числом протонов называют химическим элементом. Протонное число совпадает с порядковым номером элемента в ПС. Ядро заряжено положительно, а т.к. заряд протона = +1, нейтрона = 0, заряд ядра определяется числом протонов и равен тоже порядковому номеру элемента. Сумма протонов и нейтронов называется массовым числом элемента, потому что именно сумма протонов и нейтронов определяет массу атома. Протоны и нейтроны иногда называют нуклонами, а массовое число нуклонным. Порядковый номер (протонное число) и массовое число – важнейшие характеристики атома. Их указывают около знака химического элемента, например: 2311Na. Если у атомов одинаковое число протонов, но разное число нейтронов, такую совокупность атомов называют изотопами. Это разновидности химического элемента. Они имеют одинаковые химические свойства. Например: 126С и 136С. Иногда с другой стороны от знака химического элемента записывают число нейтронов, т.е. для 126С - 126С6, а для 136С - 136С7. Различают стабильные и радиоактивные изотопы. Зная массовую долю всех изотопов химического элемента и их массовое число мы можем вычислить среднюю атомную массу элемента. Т.к. заряд ядра равен заряду электронной оболочки, а у каждого электрона заряд (-1), то число протонов равно числу электронов.
Эти электроны двигаются по определенным орбитам вокруг ядра. Эта модель атома, предложенная Резерфордом, очень наглядна и полезна. Но сразу возник вопрос. Согласно электромагнитной теории, двигаясь по орбите с ускорением электрон должен непрерывно излучать энергию, а значит он будет двигаться по спирали и рано или поздно упадет на ядро. К этому времени была доказана дискретность электрической энергии. Поэтому Бор выдвинул гипотезу – двигаясь по орбите электрон не излучает и не поглощает энергии, это происходит только при переходе электрона с одной орбиты на другую. Причем чем меньше радиус орбиты, тем меньше энергия электрона. Значит, переходя на более удаленную орбиту электрон должен поглощать энергию, а переходя на меньшую орбиту электрон излучает энергию.
Современная теория строения атома (ТСА) возникла как результат переосмысления и дополнения теорий Резерфорда и Бора. Самым важным понятием ТСА стало понятие об электронном облаке, которое пришло на смену понятию об электроне как частице, которая двигается по определенной траектории. Современная ТСА учитывает волновые свойства электрона.
У электрона двойственная природа. Как частица он имеет определенную массу (хотя и очень маленькую даже по сравнению с протоном) и заряд, а как волна – он имеет способность огибать препятствие (дифракция). Для электрона нельзя одновременно точно измерить координаты и энергию. Он двигается с очень большой скоростью и характер движения у него – вероятностный. Т.е. он двигается не по определенной траектории, а хаотично, в пространстве около ядра, причем вероятность пребывания его в разных точках этого пространства неодинакова. Это пространство около ядра, где пребывание электрона наиболее вероятно называют электронным облаком или электронной орбиталью.
Орбитали имеют определенные размеры, форму и располагаются в пространстве определенным образом. Для характеристики этих свойств орбиталей используют квантовые числа. Их всего 4.
Главное квантовое число определяет размеры орбитали, а значит и степень удаленности от ядра. Именно от главного числа (размера орбитали) больше всего зависит энергия электрона. Орбитали приблизительно одного размера образуют электронный слой (электронный уровень). Число может иметь значения n = 1,2,3,4… и чем больше значение n, тем больше, обычно, энергия электрона. Часто строение атома изображают в виде схемы:
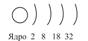 т.е. для натрия (№11) +11)2)8)1
т.е. для натрия (№11) +11)2)8)1
Уровни делят на подуровни. Причем число возможных подуровней равно номеру данного уровня. Т.е. на 1 уровне 1 подуровень, на 2 – 2, на 3 -3 и т.д.
Подуровни образованы орбиталями одинаковыми не только по размеру, но и по форме. Эту форму орбитали определяет второе (орбитальное) квантовое число. Подуровни принято обозначать буквами:
1 уровень – 1s
2 уровень – 2s, 2p
3 уровень – 3s,3p, 3d
4 уровень – 4s, 4p, 4d, 4f…
Третье квантовое число называют магнитным, оно определяет ориентацию орбитали в пространстве и число орбиталей на подуровне. Для s -подуровня число таких орбиталей на любом уровне равно 1. Для р-подуровня – 3. Для d -5. Для f – 7…

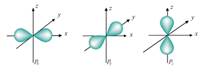
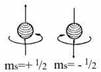 Четвертое орбитальное число характеризует собственное состояние электрона в атоме, которое, упрощенно, можно представить, как момент собственного вращения электрона. Это число может иметь только два значения, т.е. (упрощенно) вращение возможно либо в одну сторону, либо в другую. Эту характеристику электрона называют спином, а число – спиновым. Т.е. если электроны, имеют три одинаковых квантовых числа, то чтобы отличаться друг от друга, они должны иметь разное значение спина.
Четвертое орбитальное число характеризует собственное состояние электрона в атоме, которое, упрощенно, можно представить, как момент собственного вращения электрона. Это число может иметь только два значения, т.е. (упрощенно) вращение возможно либо в одну сторону, либо в другую. Эту характеристику электрона называют спином, а число – спиновым. Т.е. если электроны, имеют три одинаковых квантовых числа, то чтобы отличаться друг от друга, они должны иметь разное значение спина.
Итак, электроны размещаются на разных расстояниях от ядра, т.к. имеют разную энергию. Электронные слои образуются орбиталями, близкими по энергии. Они имеют одинаковое главное квантовое число. Эти слои часто называют электронными уровнями. Главное квантовое число (электронный уровень) равен номеру периода, в котором находится элемент.
Распределение электронов в атоме по уровням и подуровням называют электронной конфигурацией атома. Эта конфигурация записывается с помощью электронных формул. Для составления такой формулы следует знать некоторые правила.
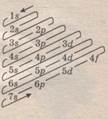 1). Правило Клечковского или принцип миниума энергии: т.е. в стабильном (стационарном) состоянии электроны сначала заполняют орбитали с меньшим уровнем энергии. Энергия электрона зависит от суммы главного и от орбитального квантового числа, то по возрастанию энергии орбитали образуют ряд:
1). Правило Клечковского или принцип миниума энергии: т.е. в стабильном (стационарном) состоянии электроны сначала заполняют орбитали с меньшим уровнем энергии. Энергия электрона зависит от суммы главного и от орбитального квантового числа, то по возрастанию энергии орбитали образуют ряд:
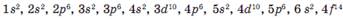
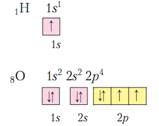 2). Принцип запрещения Паули, в атоме не может быть двух одинаковых электронов, т. е. электронов с одинаковым набором 4-х квантовых чисел. Значит на одной орбитали может быть не более двух электронов, причем, с противоположными спинами.
2). Принцип запрещения Паули, в атоме не может быть двух одинаковых электронов, т. е. электронов с одинаковым набором 4-х квантовых чисел. Значит на одной орбитали может быть не более двух электронов, причем, с противоположными спинами.
Орбитали можно условно изображать клеточками – ячейками. И в одной клеточке мы рисуем или ↓↑, или только ↓, или только↑. Но ↑↑ - запрещено принципом Паули.
 3). Правило Хунда. На одном подуровне значение спинового числа электронов должно быть максимально, а это значит, что заполнение электронами подуровня сначала происходит по одному, а только потом – происходит спаривание.
3). Правило Хунда. На одном подуровне значение спинового числа электронов должно быть максимально, а это значит, что заполнение электронами подуровня сначала происходит по одному, а только потом – происходит спаривание.
 - запрещено!
- запрещено!
К середине 19 века было известно более 60 химических элементов, но были большие трудности с их классификацией. Много попыток в этом направлении было сделано, но удалось это сделать только Д.И.Менделееву. Проанализировав все известные на тот момент данные об элементах, Менделеев сделал вывод, что «Все свойства химических элементов и их соединений находятся в периодической зависимости от их атомных масс». Эту фразу можно считать формулировкой Периодического закона (ПЗ). Графическим выражением ПЗ стала Периодическая система (ПС). Менделеев открыл ПЗ, когда о сложном строении атома ученые не имели не малейшего представления. Это была гениальная догадка, и она по праву считается величайшим научным открытием. Только в 20-е годы 20 века стало ясно, что элементы размещены в таблице по увеличению заряда ядра элементов (протонного числа), и закономерности в изменении их свойств связаны с изменением электронной конфигурации атомов.
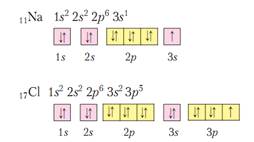 В образовании химических связей между атомами обычно принимают участие электроны внешнего электронного слоя. Их принято называть валентными. У элементов побочных подгрупп в образовании связей могут участвовать и d-электроны. Число электронов на внешнем слое для элементов главных подгрупп (s и p элементы) равно номеру группы и совпадает с максимальной валентностью и максимальной степенью окисления элемента.
В образовании химических связей между атомами обычно принимают участие электроны внешнего электронного слоя. Их принято называть валентными. У элементов побочных подгрупп в образовании связей могут участвовать и d-электроны. Число электронов на внешнем слое для элементов главных подгрупп (s и p элементы) равно номеру группы и совпадает с максимальной валентностью и максимальной степенью окисления элемента.
Для атома наиболее выгодной энергетически является электронная конфигурация заполненного (завершенного) электронного слоя - s2p6 (для 1 слоя - просто s2). (Выгодными энергетически являются также заполненные подуровни и наполовину заполненные подуровни). Поэтому все элементы стремятся завершить свой электронный слой, чтобы иметь конфигурацию s2p6. Для этого элементы либо отдают свои валентные электроны, либо присоединяют электроны, забирая у других атомов.
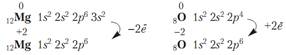
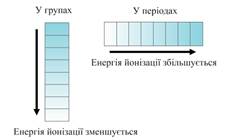
 Количество энергии, необходимой для отрыва от атома одного электрона называется энергией ионизации. Чем меньше энергия ионизации, тем больше металлических свойств проявляет элемент. Эта энергия зависит от числа электронов на внешнем слое (от силы взаимодействия между зарядом ядра и зарядом электронной оболочки). Наименьшей энергией ионизации обладают щелочные металлы, которые имеют один электрон на внешнем слое. Энергия ионизации зависит и от расстояния электрона от ядра. Чем больше радиус атома, тем слабее взаимодействует электрон с ядром и поэтому легче отрывается, т.е. энергия ионизации становится меньше. Итак, с увеличением радиуса атомов электрон слабее
Количество энергии, необходимой для отрыва от атома одного электрона называется энергией ионизации. Чем меньше энергия ионизации, тем больше металлических свойств проявляет элемент. Эта энергия зависит от числа электронов на внешнем слое (от силы взаимодействия между зарядом ядра и зарядом электронной оболочки). Наименьшей энергией ионизации обладают щелочные металлы, которые имеют один электрон на внешнем слое. Энергия ионизации зависит и от расстояния электрона от ядра. Чем больше радиус атома, тем слабее взаимодействует электрон с ядром и поэтому легче отрывается, т.е. энергия ионизации становится меньше. Итак, с увеличением радиуса атомов электрон слабее 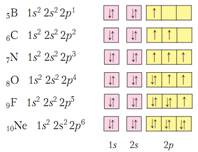 связан с ядром, поэтому в подгруппе металлические свойства усиливаются сверху вниз. Если элемент может завершать свой внешний электронный слой только отдавая электроны, он относится к металлам. Типичные металлы – это s-элементы, у которых на внешнем слое 1-2 электрона. У d-элементов идет заполнение предпоследнего слоя, а на внешнем остаются тоже 2 электрона. Значит это тоже металлы, но уже не типичные, а «переходные». Эти металлы обычно достаточно легко отдают электроны внешнего слоя, т.е. ведут себя как обычные металлы. Но при взаимодействии с некоторыми элементами они могут потерять часть или даже все электроны частично заполненого предпоследнего d-подуровня. Т.е. валентными являются не только электроны внешнего слоя, но и незаполненого подуровня. Поэтому d-элементы обычно имеют переменную валентность и степень окисления. У р-элементов на внешнем слое больше электронов, чем у s – элементов, а значит сила взаимодействия электронной оболочки с ядром тоже больше, энергия ионизации увеличивается. Поэтому металлические свойства для них не характерны. Но у р-элементов становиться возможным завершение внешнего слоя за счет притяжения к себе чужих электронов. Это свойство элементов называют электроотрицательностью (ЭО). Элементы с низкой ЭО – это металлы. Элементы с высокой ЭО относятся к неметаллам. Чем больше ЭО, тем сильнее неметаллические свойства. В периодах ЭО увеличивается с увеличением порядкового номера, в подгруппах – уменьшается. Поллингу удалось измерить эту ЭО и он расположил элементы в ряд по уменьшению ЭО:
связан с ядром, поэтому в подгруппе металлические свойства усиливаются сверху вниз. Если элемент может завершать свой внешний электронный слой только отдавая электроны, он относится к металлам. Типичные металлы – это s-элементы, у которых на внешнем слое 1-2 электрона. У d-элементов идет заполнение предпоследнего слоя, а на внешнем остаются тоже 2 электрона. Значит это тоже металлы, но уже не типичные, а «переходные». Эти металлы обычно достаточно легко отдают электроны внешнего слоя, т.е. ведут себя как обычные металлы. Но при взаимодействии с некоторыми элементами они могут потерять часть или даже все электроны частично заполненого предпоследнего d-подуровня. Т.е. валентными являются не только электроны внешнего слоя, но и незаполненого подуровня. Поэтому d-элементы обычно имеют переменную валентность и степень окисления. У р-элементов на внешнем слое больше электронов, чем у s – элементов, а значит сила взаимодействия электронной оболочки с ядром тоже больше, энергия ионизации увеличивается. Поэтому металлические свойства для них не характерны. Но у р-элементов становиться возможным завершение внешнего слоя за счет притяжения к себе чужих электронов. Это свойство элементов называют электроотрицательностью (ЭО). Элементы с низкой ЭО – это металлы. Элементы с высокой ЭО относятся к неметаллам. Чем больше ЭО, тем сильнее неметаллические свойства. В периодах ЭО увеличивается с увеличением порядкового номера, в подгруппах – уменьшается. Поллингу удалось измерить эту ЭО и он расположил элементы в ряд по уменьшению ЭО:
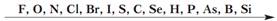
Т.е. наиболее ярко неметаллические свойства проявляет фтор.
Свойства химических элементов зависят от строения их электронных оболочек. Это строение (электронная конфигурация) закономерно изменяется и повторяется через определенное число элементов. Элементы имеющие похожее строение образуют «естественные семейства химических элементов», очень похожих по своим свойствам друг на друга. Они входят в одну подгруппу ПС.
Современная формулировка ПЗ читается так: «Свойства химическихэлементов и их соединений изменяются периодически с возрастанием заряда ядра атомов химических элементов, потому что периодически изменяется электронная конфигурация атомов этих элементов». Зная положение элемента в ПС, мы может характеризовать его электронное строение и свойства.
Характеристика элемента по ПС (план)
1) положение в ПС (порядковый номер, период, группа, подгруппа, атомная масса)
2) состав атома (число протонов, нейтронов, электронов)
3) распределение электронов по уровням, подуровням, орбиталям (схема строения, электронная формула, квантовые ячейки).
4)характеристика электронного строения и свойств элемента и его соединений (число электронных слоев, завершен ли внешний электронный слой, сколько на нем электронов, какова ЭО элемента, характерные степени окисления; число неспаренных электронов, свободных орбиталей, возможная валентность элемента, характеристика соединений элемента-оксида и гидроксида, ЛВС); Вывод: металлические или неметаллические свойства преобладают у элемента, и сравнение свойств этого элемента с соседями по периоду и подгруппе.
 2015-10-13
2015-10-13 1212
1212








