Растворимость веществ в жидких растворителях существенно зависит от их химической природы, свойств растворителя, температуры и давления. В качестве растворителей в промышленности наиболее часто используют воду, а также ряд органических соединений-спирты, углеводороды и др.
Как правило, растворимость большинства веществ с повышением температуры увеличивается. При понижении температуры такие растворы становятся пересыщенными и переходят в состояние неустойчивого равновесия, продолжительность которого определяется степенью отклонения от равновесия, свойствами растворенного вещества и растворителя. Переход из неравновесного состояния в равновесное сопровождается выпадением кристаллов, т.е. возникновением процесса кристаллизации. На величину предельного (максимального) пересыщения оказывают влияние свойства растворенного вещества и раствори геля, температура раствора, скорость охлаждения, наличие примесей, механические воздействия и т.д. Поэтому обычно величину предельного пересыщения определяют экспериментально или по приближенным эмпирическим уравнениям.
Зависимость между давлением и температурой при фазовом
переходе в условиях кристаллизации выражаемся уравнением Клапейрона -Клаузиуса:
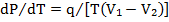
где q- теплота кристаллизации (из жидкого или газообразного состояния);
V1 - удельный объем вещества в жидком состоянии (при переходе жидкость – твердое тело) или в газообразном состоянии (при переходе газ-твердое тело); V2- удельный объем вещества в твердом состоянии.
Обычно V1 > V2, поскольку удельный объем большинства веществ при переходе в твердое состоянии уменьшается вследствие увеличения плотности. Очевидно, при этом dP/dT > 0. т.е. давление Р, при котором совершается фазовый переход, растет с увеличением температуры.
На рис. 23-1 представлена диаграмма состояний газ - жидкость -
твердое тело. Точка А является тройной: в ней в равновесии одновременно находятся газ, жидкость и твердое тело, что соответствует правилу фаз Гиббса. Действительно, для однокомпонентной системы К=1, Ф=3 (для точки А), и число степеней свободы
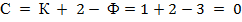
т. е. при изменении любого параметра (температуры или давления)
произойдет исчезновение одной или двух фаз (Т, Ж, П).
Линия ОА является кривой сублимации, она отражает условия перехода твердой фазы в паровую, минуя жидкое состояние, или наоборот (процесс десублимации). Выше давления Р1, тройной точки А, но ниже давления РКР переход из газообразного в твердое состояние может быть осуществлен только через жидкую фазу.
Линия АК является кривой перехода жидкости в газообразное состояние. Точка К характеризует критическое состояние системы. При температуре выше критической tкр исчезает различие между газом и жидкостью.
Линия АВ отражает условия перехода жидкости в твердую фазу и не имеет конца, а продолжается безгранично вверх. Объясняется это тем, что жидкая фаза в отличие от кристаллической не имеет строго определенной структуры.
Анализ условий равновесия в бинарных и многокомпонентных системах удобно проводить с помощью фазовых диаграмм в координатах концентрация -температура. Для чистых веществ такие зависимости приводятся в справочной литературе.
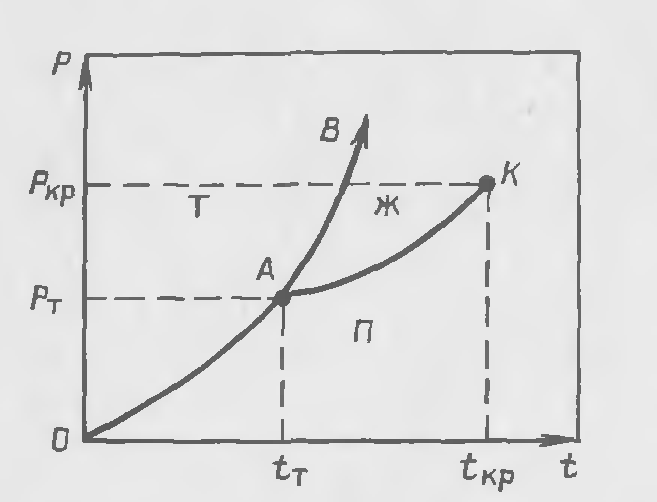
Рис.23-1. Диаграмма состояний газ (пар) - жидкость твердое тело (П, Ж,Т)
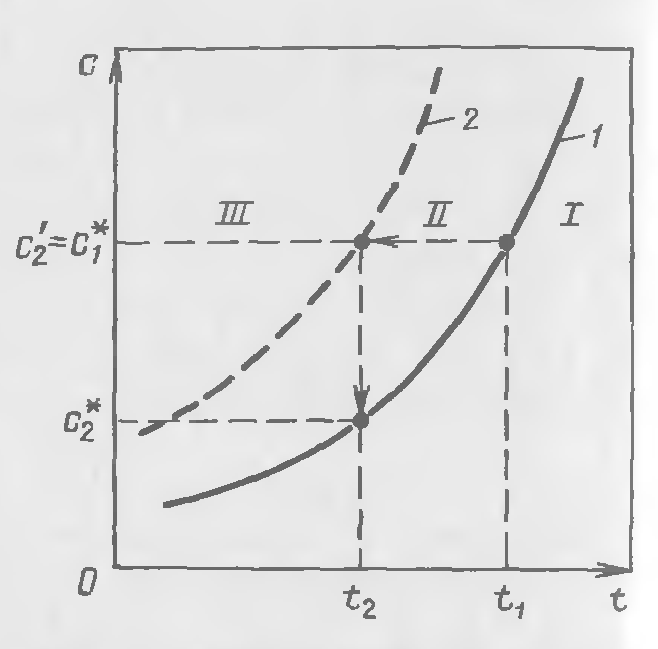
Рис. 23-2. Зависимость равновесной концентрации (1) и пересыпания (2) от температуры:
I- III области соответственно ненасыщенного раствора, метастабильная и лабильная
На рис. 23-2 показана зависимость концентрации, соответствующей условиям растворимости (кривая 1) и пересыщения (кривая 2) данного вещества, от температуры. На этом рисунке можно выделить три области. Область I соответствует состоянию раствора до насыщения (ниже линии насыщения 1); кристаллизации в этой области не происходит. Пунктирная линия 2 делит область пересыщенных растворов на две части на относительно устойчивую, или метастабильную, область II и неустойчивую, или лабильную, область III, в которой происходит массовая кристаллизация.
Пересыщенные растворы с концентрациями, соответствующими области III, кристаллизуются очень быстро, почти мгновенно. В метастабильной области II пересыщенные растворы какое-то время остаются без существенных изменений, происходит только рост кристаллов, уже имеющихся в растворе. Следует отметить, что
граница между областями II и III условна и зависит от ряда факторов, отмеченных выше. У растворов с резко возрастающей кривой растворимости при относительно небольшом снижении температуры насыщенного раствора от t1 до t2 (см. рис. 23-2) состояние раствора изменяется по линии C1* C2’ выделением кристаллов по достижении концентрации C2’, вследствие чего концентрация раствора снижается по линии C2’ C2*. Кристаллизацию подобных растворов целесообразно проводить их охлаждением, т.е. изогидрическим методом, что позволит быстро перевести состояние таких растворов от насыщения в благоприятную для кристаллизации метастабильную, а затем в лабильную области.
Если растворимость кристаллизуемого вещества очень мало зависит от температуры, то проводить процесс кристаллизации такого раствора изогидрическим методом нецелесообразно. В этом случае более рационально осуществлять кристаллизацию путем удаления части растворителя, например выпариванием, т.е. изотермическим методом.
В промежуточном случае, когда растворимость веществ с увеличением температуры растет, но вяло, можно использовать как изогидрический, так и изотермический метод или их сочетание. Наиболее рациональный выбор метода кристаллизации таких расстворов может быть сделан только в результате технико-экономического расчета.
 2015-10-14
2015-10-14 1902
1902