Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
Высшего профессионального образования
«Тульский государственный университет»
Кафедра химии
ХИМИЯ
Методические указания для студентов
технических направлений бакалавриата
очной формы обучения
Тула 2013
| Разработали: | Л.Д. Асулян, к.х.н., доцент И.В. Блохин, к.х.н., доцент А.А. Горячева, к.х.н., доцент Е.Д. Дмитриева, к.х.н., доцент Т.Д. Карташова, к.х.н., доцент Н.А. Морозова, к.х.н., доцент С.Ф. Хлебникова, к.х.н., доцент |
ОГЛАВЛЕНИЕ
Лабораторная работа № 1. СВОЙСТВА ГИДРОКСИДОВ.. 4
Лабораторная работа № 2. ТИТРОВАНИЕ РАСТВОРОВ. ОПРЕДЕЛЕНИЕ ЖЕСТКОСТИ ВОДОПРОВОДНОЙ ВОДЫ... 7
Лабораторная работа № 3. ОПРЕДЕЛЕНИЕ ЭНТАЛЬПИИ РЕАКЦИИ НЕЙТРАЛИЗАЦИИ СИЛЬНОЙ КИСЛОТЫ СИЛЬНЫМ ОСНОВАНИЕМ... 21
Лабораторная работа № 4. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ И ХИМИЧЕСКОЕ РАВНОВЕСИЕ 21
Лабораторная работа № 5. ОПРЕДЕЛЕНИЕ КОНСТАНТЫ РАВНОВЕСИЯ ГОМОГЕННОЙ РЕАКЦИИ 21
Лабораторная работа № 6. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ. ПОЛУЧЕНИЕ И ИЗУЧЕНИЕ СВОЙСТВ АММИНО-, ГИДРОКСО- И АЦИДОКОМПЛЕКСОВ.. 21
Лабораторная работа № 7. ГИДРОЛИЗ СОЛЕЙ.. 21
Лабораторная работа № 8. СВОЙСТВА СОЕДИНЕНИЙ d-ЭЛЕМЕНТОВ.. 21
Лабораторная работа № 9. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ.. 21
Лабораторная работа № 10. КОРРОЗИЯ МЕТАЛЛОВ И МЕТОДЫ ЗАЩИТЫ... 21
Лабораторная работа № 11. УСТОЙЧИВОСТЬ ДИСПЕРСНЫХ СИСТЕМ И КОАГУЛЯЦИЯ КОЛЛОИДНЫХ РАСТВОРОВ.. 21
Лабораторная работа № 1. СВОЙСТВА ГИДРОКСИДОВ
Цель работы
Изучить реакции получения и свойства гидроксидов.
1.2. Объекты и средства исследования: 0,5М растворы сульфата меди(II), сульфата алюминия, хлорида хрома(III), силиката натрия, 2M растворы сернойи соляной кислот, гидроксида натрия, гидроксида бария, хромовый ангидрид – кристаллический, универсальная индикаторная бумага.
Программа работы
1.3.1. Получение и установление характера гидроксида меди.
В две пробирки налить по 5 капель раствора соли меди. В каждую пробирку добавить по каплям 2М раствор щелочи до образования осадка. Отметить цвет осадка. В одну пробирку добавить 10-15 капель 2М раствора серной кислоты, в другую - 10-15 капель 2М раствора щелочи. Написать уравнения реакций в молекулярном и ионном виде.
Сделать выводы о способе получения и характере гидроксида.
1.3.2. Получение и установление характера гидроксида алюминия.
В пробирку налить 5-10 капель 2М раствора щелочи, добавить по каплямраствор соли алюминия до образования осадка и разделить осадок на две части. К одной прилить 10-15 капель 2М раствора серной кислоты, к другой – 10-15 капель 2М раствора щелочи. Написать уравнения реакций в молекулярном и ионном виде.
Учтите,что при взаимодействии гидроксида алюминия с растворами щелочей образуются комплексные соединения – Na[Al(OH)4] илиNa3[Al(OH)6]
Сделать выводы о способе получения и характере гидроксида.
1.3.3. Получение и установление характера гидроксида кремния.
Налить в пробирку 5 капель силиката натрия и добавить раствор хлористоводородной кислоты до выпадения студенистого осадка. Осадок разделить на две части, к одной прилить 10-15 капель 2М раствора хлористоводородной кислоты, к другой - 10-15 капель 2М раствора щелочи. Написать уравнения реакций в молекулярном и ионном виде.
Сделать выводы о способе получения и характере гидроксида.
1.3.4. Зависимость характера гидроксидов d -элементов от степени окисления (на примере соединений хрома).
1.3.4.а. Налить в пробирку 5 капель 2М раствора щелочи и прилить к нему по каплям раствор хлорида хрома (III) до появления серо-зеленого осадка гидроксида хрома (III). Установить характер полученного гидроксида. Написать молекулярные и ионные уравнения проведенных реакций.
Сделать вывод о характере гидроксида хрома (III).
1.3.4.б. Несколько кристалликов оксида хрома (VI) поместить в пробирку, прилить 2-3 мл дистиллированной воды. Написать уравнения реакций взаимодействия хромового ангидрида с водой. Установить характер гидроксида хрома (VI) по взаимодействию его с гидроксидом бария. Написать уравнение реакции.
На основании 1.3.4.а и 1.3.4.б сделать вывод о зависимости характера гидроксидов хрома от степени окисления.
1.5. Контрольные вопросы.
1.5.1. Назовите соединенияА, B и С. К каким классам соединений они относятся (оксиды, гидроксиды, соли)? Укажите характер гидроксидов и тип соли.
1.5.2. Определите степень окисления подчеркнутого элемента в соединении В.
1.5.3. Напишите уравнения реакций, характеризующих свойства соединения С. Приведите примеры реакций его получения.
| Номер варианта | A | B | C | |
| KHSO3 CuO (BeOH)2CO3 HNO2 H2WO4 Na3AsO4 Na2HAsO3 CuOH FeO Cd(OH)2 SiO2 CrO3 B2O3 Fe(OH)3 Ba(OH)2 KOH Al(OH)2Cl FeOH(NO3)2 HClO4 Mg(OH)2 KHS (NH4)2SO4 N2O5 H2SiO3 Fe(OH)2 CrOHSO4 AgNO3 Mn2O7 HMnO4 KNO2 KCrO2 (FeOH)2SO4 Са(НSO3)2 NaHS NaAlO2 | Al(OH)3 H3PO4 P2O5 K2HВO3 CuOHNO3 H2SeO4 HBrO4 Ca(HCO3)2 Na3PO4 Fe2O3 Zn(OH)2 AlOHCl2 NaAlO2 ZnCO3 NH4NO3 LiHSO4 HIO3 H2SeO3 NiO CuS SeO3 Sr(OH)2 Ni3(PO4)2 NaHCO3 H2MoO4 Cl2O7 Fe(OH)2 Sn(OH)2Cl2 BaO, Ca(ClO4)2 (NH4)2S H2SO3 SO2 K3PO4 CaBr2 | K2 Сr 2O7 KH S O4 NH4 N O3 I 2O5 Fe C O3 (CuOH)2 S O4 Ca3(Р О4)2 H Cl O4 CuOH N O3 Zn C O3 Li2 S O4 Na Cr O2 H N O2 Ge Сl4 NaH S O3 H Cl O3 K2 Cr O4 Ba S O4 Ca C O3 Cr O3 (N H4)2СO3 H3 As O4 NaH2 B O3 Fe 2(SO4)3 (NH4)2 S O4 H Cl O H Br O3 KH S O3 Zn(OH) N O3 H2 Cr O4Na3 As O4 NaH C O3 N H4 N O2 N H4H S K2 Cr 2O7 | SeO2 Zn(OH)2 H2CO3 Ni(OH)2 KOH H2SeO3 NaOH Sn(OH)2 H2SO4 K2O HClO4 HMnO4 Рb(ОН)2 HClO ZnO MgO BaO CsOH Be(OH)2 H3PO4 SO2 Na2O Pb(OH)2 Ca(OH)2 MnO2 Cd(OH)2 P2O5 Mg(OH)2 CaO Ba(OH)2 Cr2O3 CaO Al(OH)3 CO2 ZnO | |
1.6. Приложение.
Названия наиболее распространенных кислот и их анионов
| Формула | Название кислоты | Название аниона кислоты |
| HF HCl HBr HI H2S HCN H3BO3 H2CO3 CH3COOH H2SiO3 HNO2 HNO3 H3PO4 H3AsO3 H3AsO4 H2SO3 H2SO4 H2SeO4 HClO HClO2 HClO3 HClO4 HBrO3 HIO3 H2CrO4 H2Cr2O7 HMnO4 | фтороводородная (плавиковая) хлороводородная (соляная) бромоводородная иодоводородная сероводородная циановодородная борная угольная уксусная кремниевая азотистая азотная фосфорная мышьяковистая мышьяковая сернистая серная селеновая хлорноватистая хлористая хлорноватая хлорная бромноватая йодноватая хромовая дихромовая марганцовая | фторид хлорид бромид иодид сульфид цианид борат карбонат ацетат силикат нитрит нитрат фосфат арсенит арсенат сульфит сульфат селенат гипохлорит хлорит хлорат перхлорат бромат иодат хромат дихромат перманганат |
Лабораторная работа № 2. ТИТРОВАНИЕ РАСТВОРОВ. ОПРЕДЕЛЕНИЕ ЖЕСТКОСТИ ВОДОПРОВОДНОЙ ВОДЫ
2.1. Цель и задачи работы
Изучить метод объемного анализа растворов(титрование) при определении временной жесткости водопроводной воды.Научиться производить расчеты по концентрации электролитов и жесткости воды.
2.2.1. Способы выражения концентрации растворов
Концентрацией раствора называется содержание растворенного вещества в определенной массе или объеме раствора или растворителя.
| Способ выражения концентрации | Формула | |
| Название и определение | Обозначения и единица измерения | |
| Массовая доля – число граммов растворенного вещества в 100г раствора | ω, % |  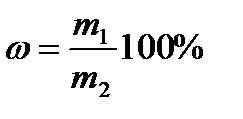 |
| Молярная – число моль растворенного вещества на 1 литр раствора | См, 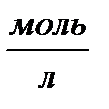 | 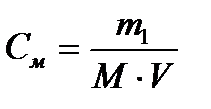 |
| Эквивалентная (нормальная) – число моль эквивалентов растворенного вещества на 1 литр раствора | Cн, 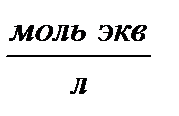 | 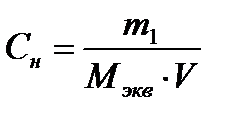 |
| Титр раствора – число граммов растворенного вещества, содержащихся в 1 мл раствора | Т, 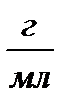 | 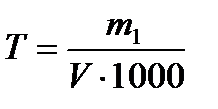 |
| Моляльная – число моль растворенного вещества в 1 кг растворителя | Сm, 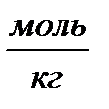 | 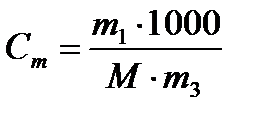 |
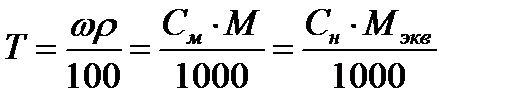 , где
, где
m1– масса растворенного вещества, г
m2 –масса раствора, г
m3 – масса растворителя, г
V– объем раствора, л
М – молярная масса, г/моль
Мэкв– молярная масса эквивалентов, г/мольэкв
r - плотность раствора, г/см3 (г/мл)
ω – массовая доля, %
Основные понятия химии и единицы их измерения в системе СИ
1. Основная единица измерения количества вещества - моль. Моль - количество вещества, содержащее столько же структурных единиц (молекул, атомов,ионов, электронов), сколько содержится атомов в 12 г изотопа углерода С12, то есть 6,02×1023молекул/моль. Поэтому необходимо указывать,например,"моль молекул воды", "моль атомов водорода","моль ионов магния".
2. Молярная масса - масса 1 моль вещества. Обозначение М, единицы измерения г/моль.
Например: 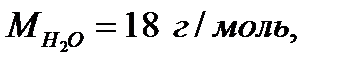
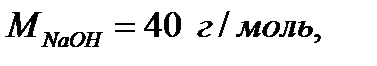
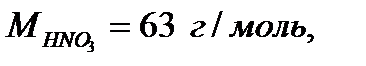
3. Эквивалент - реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Закон эквивалентов: вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам.
4. Молярная масса эквивалентов–масса 1 моль эквивалентов, содержащая 6,027×1023 эквивалентов. Обозначение МЭКВ, единицы измерения г/моль (или г/мольэкв).
Молярная масса - это абсолютная константа индивидуального вещества. Молярная масса эквивалента- константа вещества в конкретной реакции.
Ниже приведены формулы для вычисления молярных масс эквивалентов сложных веществ:
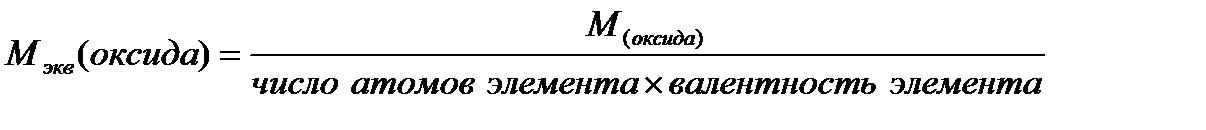
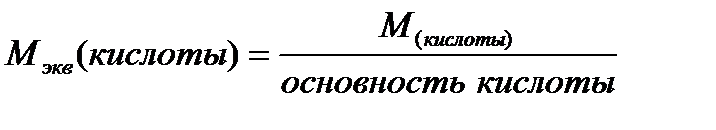
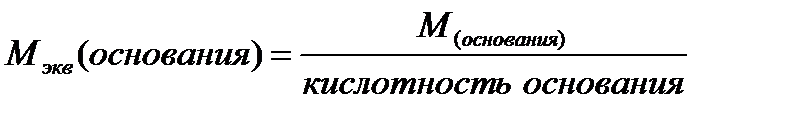
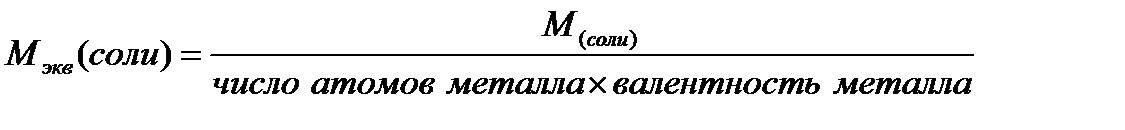
где: М - молярная масса соединения
Основность кислоты определяется числом ионов водорода, которое отдает молекула кислоты, реагируя с основанием.
Количество гидроксильных групп в молекуле основания определяет его кислотность.
Примеры расчетов:
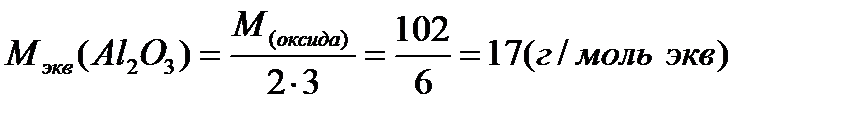
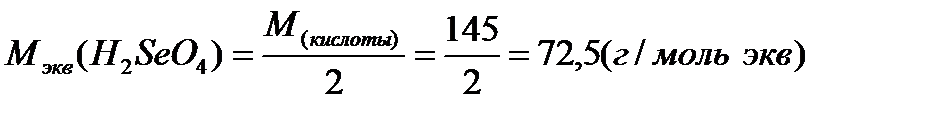
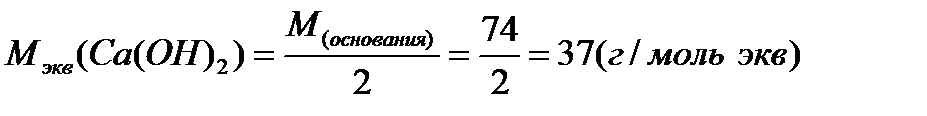
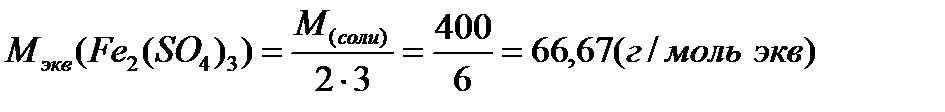
Молярная масса эквивалента одного и того же вещества зависит от течения реакции:
H2SO4 + NaOH = NaHSO4 + H2O
H2SO4 + 2NaOH = Na2SO4 + 2H2O
В первом случае эквивалентная масса H2SO4 равна ее молярной массе, во втором - половине молярной массы, так как в первом случае в реакции принимает участие один атом водорода, а во втором два атома водорода
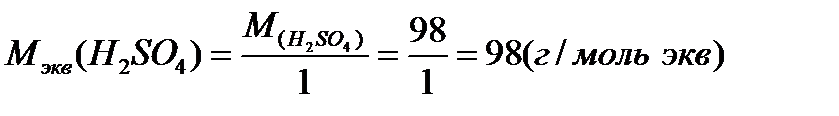
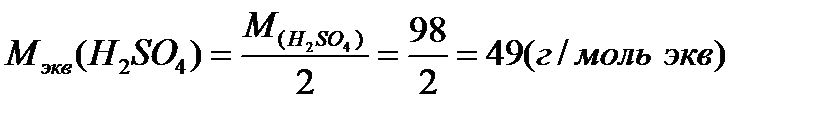
Раствор, содержащий в одном литре один моль растворенного вещества, называется одномолярным(1,0М); 0,1 моль – децимолярным (0,1М); 0,01 моль–сантимолярным (0,01М).
Раствор, содержащий в одном литре один моль эквивалентов растворенного вещества, называется однонормальным (1,0н); 0,1 моль эквивалента – децинормальным (0,1н); 0,01 моль эквивалента – сантинормальным (0,01н).
Растворы различной концентрации реагируют в объемах обратно пропорциональных их нормальным концентрациям (закон эквивалентов для растворов):
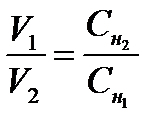
Если концентрация растворов невелика, например,концентрация солей в природных водах, то вместо эквивалентной концентрации в растворах используют тысячную долю ее –миллиэквивалент(мэкв/л).
Концентрация в миллимолях эквивалентовионов Са2+ и Mg2+на литрводы называется жесткостью воды, таким образом:
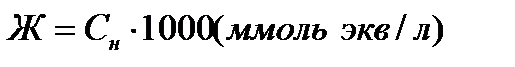
Примеры решения задач по теме «Концентрация растворов»
Задача 1. Какую массу воды и массу соли надо взять для приготовления 40кграствора с массовой долей сульфата натрия 12%?
Решение:
исходя из формулы 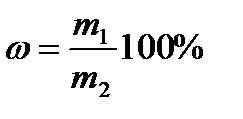 ,определим массу сульфата натрия:
,определим массу сульфата натрия:
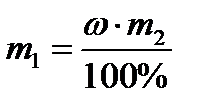 ;
; 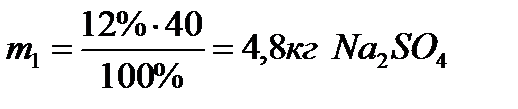
Масса воды равна m2 - m1 = 40 - 4,8 = 35,2 кг Н2О
Ответ: для приготовления 40 кг раствора с массовой долей 12% необходимо взять 4,8 кг сульфата натрия и 35,2 кг воды.
Задача 2. Сколько граммов соды Na2CO3 содержится в 500 мл 0,25нраствора?
Решение:
1) Массу соды определяем по формуле эквивалентной концентрации:
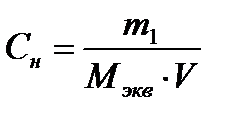 ;
; 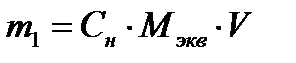
2) Молярную массу эквивалентов соды рассчитаем по формуле:
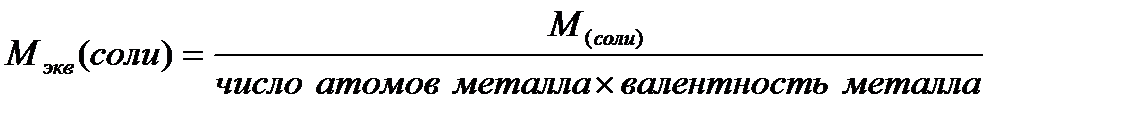
где: 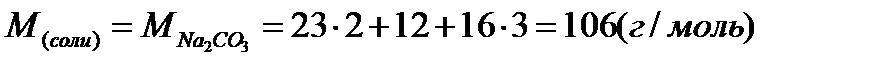 ,
,
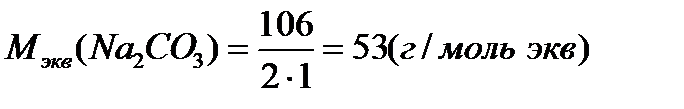
масса соды: m1 = 0,25 × 53 × 0,5 = 6,625 г.
Ответ: в 500 мл 0,25 н раствора содержится 6,625 г Na2CO3.
Задача 3. Определите массовую долю Н3PO4 в 2нрастворе плотностью 1,32г/мл.
Решение:
Массовую долю Н3РО4 определяем исходя из формулы, связывающей массовую долю с эквивалентной концентрацией:
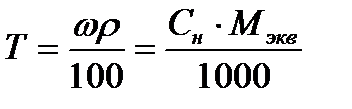 ;
; 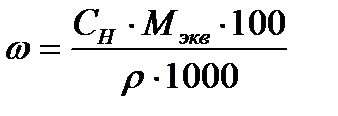 ;
;
где 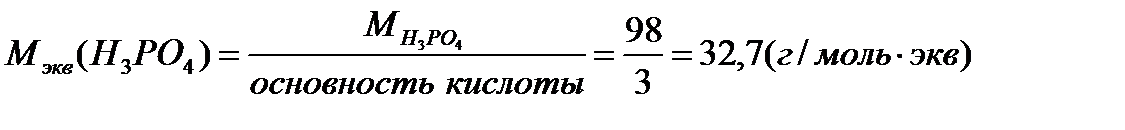 ;
;
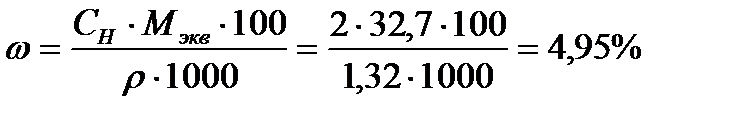
Ответ: массовая доля Н3РО4 в 2 н растворе, плотностью 1,32 г/мл равна 4,95%.
Задача 4. Какова молярная концентрация 20% раствора соляной кислоты (r = 1,10 г/мл)?
Решение:
Исходя из формулы:
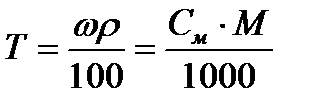
находим: 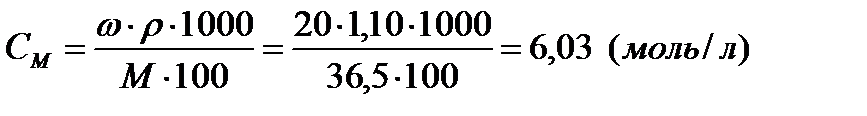
Ответ: молярность 20% раствора НСl равна 6,03 моль/л.
Задача 5. Какую массу карбоната натрия надо добавить к 7 л воды, чтобы устранить общую жесткость воды, равную 7,5 ммольэкв/л?
Решение:
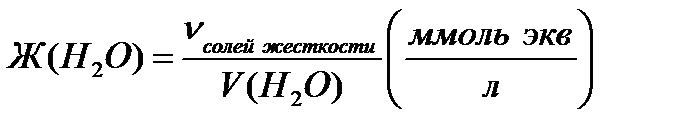
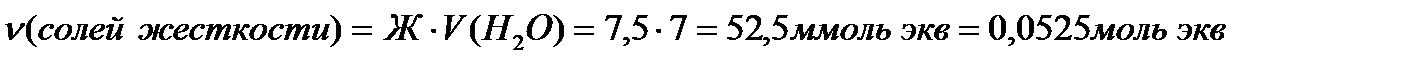
Согласно закону эквивалентов:
nэкв(Na2CO3)= nэкв (солей жесткости) = 0,0525 моль экв.
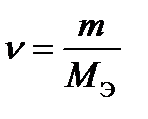 ;
; 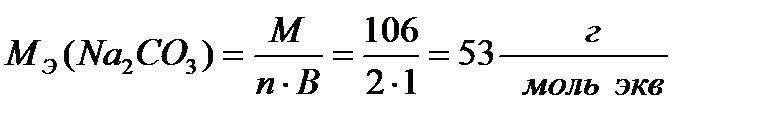
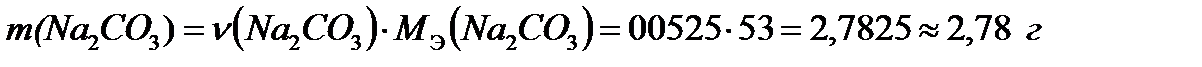
Ответ: для устранения общей жесткости воды надо добавить 2,78 г карбоната натрия.
 2015-10-14
2015-10-14 1249
1249







