2.3. Объекты и средства исследования: cтандартный раствор хлороводородной (соляной) кислоты (0,1н), раствор метилоранжа, бюретка на 50 или 100 мл, колба коническая емкостью 250 мл, колба мерная емкостью 100 мл, коническая воронка.
2.4. Подготовка к работе
Тщательно помойте посуду (при необходимости с помощью ерша) и проверьте наличие необходимых реактивов.
2.5. Программа работы
Временную жесткость воды определяют титрованием анализируемой воды раствором соляной кислоты с установленной нормальностью.
Титрование – один из методов химического анализа. В основе процесса титрования соляной кислотой водопроводной воды с солями жесткости лежат реакции:
Ca(HCO3)2 + 2HCl = CaCl2 + 2H2O + 2CO2
Mg(HCO3)2 + 2HCl = MgCl2 + 2H2O + 2CO2
Вещества реагируют в эквивалентных количествах. Точка эквивалентности определяется с помощью индикатора метилоранжа. Метилоранж в щелочном растворе окрашивается в желтый цвет, в кислом – в розовый, в нейтральном –взолотисто-оранжевый.
1. Наполните бюретку стандартным раствором соляной кислоты (0,1 н) и приведите ее в рабочее положение (удалите пузырек воздуха из оттянутого капилляра, установите нижний край мениска на нуль).
2. Налейте в мерную колбу 100 мл водопроводной воды.
3. Отмеренный объем воды (100 мл) перелейте в коническую колбу для титрования и добавьте 2-3 капли индикатора метилоранжа.
4. Установите колбу с отмеренным количеством воды под бюретку и приливайте по каплям стандартный раствор соляной кислоты до появления золотисто-оранжевого окрашивания. При титровании жидкость необходимо все время взбалтывать.
5. Заметьте и запишите количество миллилитров соляной кислоты, налитой из бюретки.Титрование повторяют 2 - 3 раза.
6. Зная средний объем титрованного раствора соляной кислоты, рассчитайте жесткость воды. Результаты запишите в таблицу 2.1.
Таблица 2.1.
Объем воды 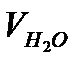 , мл , мл | Объем 0,1 н раствора HCl 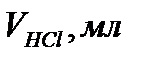 |   | 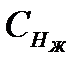 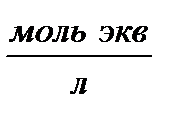 | Жесткость воды Ж, 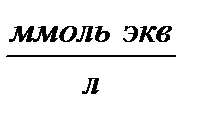 | ||
Определяем концентрацию солей, дающих временную жесткость (гидрокарбонатов кальция и магния Снж).
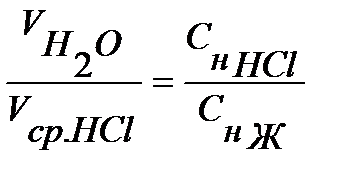
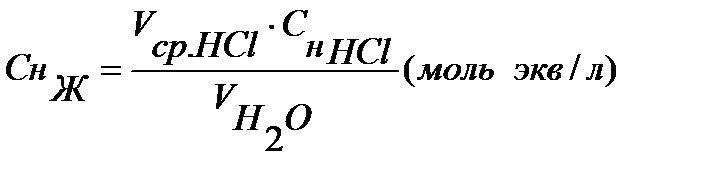
Ж=СнЖ×1000 (ммольэкв/л)
Контрольные вопросы
2.6.1. Решите следующую задачу, соответствующую вашему варианту (см. таблицу).Навеску соли массой A растворили в воде массой B. При этом образовался раствор с массовой долей соли С. В таблице представлены две величины из трех. Найдите неизвестную величину. Ответ округлите с точностью до целых.
| Номер варианта | A | B | C |
| Масса соли, г | Масса воды, г | Массовая доля соли, % | |
| 4,76 | |||
| 4,26 | |||
| 3,85 | |||
| 11,76 | |||
| 6,25 | |||
| 5,51 | |||
| 16,67 | |||
| 10,45 | |||
| 6,98 | |||
| 6,25 | |||
| 13,04 | |||
| 10,00 | |||
| 7,41 | |||
| 25,00 | |||
| 11,76 | |||
| 9,77 | |||
| 28,57 | |||
| 17,81 | |||
| 11,11 | |||
| 9,64 |
2.6.2. Решите следующую задачу, соответствующую вашему варианту (см. таблицу). Имеется раствор вещества A с известной плотностью B. В таблице приводится один из способов выражения концентрации данного раствора (C, D, E, F). Рассчитайте остальные. Ответ округлите с точностью до десятитысячных.
| Номер варианта | A | B | C | D | E | F |
| Формула | Плотность, г/мл | Массовая доля, % | Молярная концентрация, моль/л | Молярная концентрация эквивалента, моль экв/л | Титр, г/мл | |
| AgNO3 | 1,088 | |||||
| AlCl3 | 1,071 | 0,6405 | ||||
| CuSO4 | 1,107 | 1,3872 | ||||
| BaBr2 | 1,016 | 0,0203 | ||||
| H2SO4 | 1,045 | 6,955 | ||||
| CaCl2 | 1,177 | 2,121 | ||||
| HCl | 1,160 | 10,22 | ||||
| K2CO3 | 1,110 | 0,1332 | ||||
| HNO3 | 1,330 | 53,41 | ||||
| Al2(SO4)3 | 1,061 | 0,1859 | ||||
| КОН | 1,330 | 24,15 | ||||
| H3PO4 | 1,550 | 1,130 | ||||
| FeSO4 | 1,008 | |||||
| NaCl | 1,100 | 2,636 | ||||
| Ba(NO3)2 | 1,032 | 0,3158 | ||||
| NaOH | 1,400 | 0,5180 | ||||
| K2Cr2O7 | 1,034 | |||||
| FeCl3 | 1,182 | 1,457 | ||||
| H3PO4 | 1,140 | 8,400 | ||||
| H2SO4 | 1,350 | 12,46 | ||||
| MgSO4 | 1,219 | |||||
| Ca(NO3)2 | 1,077 | 0,6564 | ||||
| ZnSO4 | 1,040 | 0,2578 | ||||
| HCl | 1,065 | 0,1438 | ||||
| NH4Cl | 1,034 | |||||
| CsCl | 1,098 | 0,7828 | ||||
| H2SO4 | 1,500 | 18,40 | ||||
| Fe2(SO4)3 | 1,050 | 0,0630 | ||||
| Cu(NO3)2 | 1,069 | |||||
| CH3COOH | 1,026 | 3,417 |
2.6.3. Задачи для самостоятельного решения.
1. Вычислить молярную и нормальную концентрацию 48% раствора азотной кислоты, имеющего плотность 1,298 г/мл. Сколько миллилитров этого раствора потребуется для нейтрализации 20 мл 6 н раствора гидроксида натрия?
2. Определите массовую долю серной кислоты в растворе, если к 1 л 20% кислоты (плотность 1,139 г/мл) добавить 1 л воды?
3. На нейтрализацию 20 мл раствора, содержащего в одном литре 12 г щелочи, было израсходовано 24 мл 0,25 н раствора кислоты. Рассчитайте молярную массу эквивалентов щелочи.
4. Сколько моль содержит 0,5 л 0,03 М раствора сульфата меди?
5. На титрование 25 мл раствора гидроксида калия расходуется 23,25 мл соляной кислоты (ТНСl = 0,007352 г/мл). Найти нормальную концентрацию раствора гидроксида калия.
6. В 1 литре раствора серной кислоты содержится 49 г H2SO4. Рассчитайте молярную концентрацию данного раствора серной кислоты.
7. Рассчитайте молярную и нормальную концентрацию раствора, если в1 литре его содержится 20 г гидроксида натрия.
8. Определите массовую долю вещества в растворе, содержащем в 140г воды 20 г сахара.
9. Сколько граммов иода и спирта надо взять для приготовления 300г
10% раствора?
10. Сколько граммов хлорида железа (III) необходимо для приготовления 2 л 0,5 н раствора?
11. Вычислить молярную концентрацию раствора, в 0,04 л которого содержится 1,74 г сульфата калия.
12. Какая масса серной кислоты содержится в 1литре 5 н раствора?
13. Какую массу соли и воды необходимо взять для приготовления 30 кграствора с массовой долей соли 15%?
14. Рассчитайте массу хлорида калия, необходимую для приготовления300 мл 0,15 М раствора.
15. Вычислить титр 0,25 М раствора серной кислоты.
16. Чему равен титр 0,2 н раствора азотной кислоты.
17. Рассчитайте титр раствора, содержащего 30 г сульфида калия в 300 мл раствора.
18. Водный раствор содержит 577 г серной кислоты в 1 литре, плотность раствора 1,335 г/мл. Определить массовую долю серной кислоты.
19. Вычислить молярную концентрацию 15% раствора сульфата меди, плотность которого 1,107 г/мл.
20. Вычислить массовую долю 2 нраствора гидроксида натрия плотностью 1,08 г/мл.
21. Плотность 1,4 М раствора серной кислоты составляет 1,085 г/мл.
Вычислить массовую долю серной кислоты в данном растворе.
22. Определить объем воды (мл) и массу нитрата калия (г), необходимыедля приготовления 400 г 20% раствора?
23. Рассчитайте титр 2 М раствора сульфата меди.
24. В каком объеме воды (мл) необходимо растворить 50 г бромида калия для получения 10% раствора?
25. Определите массовую долю фосфорной кислоты в2 н растворе, плотностью 1,32 г/мл.
26. Вычислить молярную концентрацию эквивалента (нормальность) 10% раствора сульфата меди, плотность которого равна 1,107 г/мл.
27. Рассчитайте массовую долю фосфорной кислоты в 6,6 М растворе, плотностью 1,32 г/мл.
28. Вычислите молярную и нормальную концентрацию 16% раствора хлорида алюминия плотностью 1,149 г/мл.
29. Определите молярную концентрацию раствора, полученного при растворении 42,6 г сульфата натрия в 300 г воды, если плотность полученного раствора равна 1,12 г/мл.
30. Определите молярную концентрацию и нормальность 30% раствора серной кислоты, имеющего плотность 1,204 г/мл.
31. Определите молярную концентрацию и нормальность 47,7% раствора фосфорной кислоты, плотность которого равна 1,315 г/мл.
32. Определите массовую долю соляной кислоты в 8 М растворе плотностью 1,23 г/мл.
33. Вычислите, какиемассы 60% раствора хлорида натрия и воды потребуются для приготовления 3 кг 10% раствора.
34. Смешано 200 г 5% раствора и 100 г 10% раствора одного и того же вещества. Определите массовую долю вещества в полученном растворе.
35. Какой объем раствора серной кислоты плотностью 1,8 г/мл с массовой долей Н2SО4 88% надо взять для приготовления раствора кислоты объемом 20мл и плотностью 1,3 г/мл с массовой долей серной кислоты 40%?
36. Определить объем аммиака (условия нормальные), который необходимо растворить в 249 г воды для получения 35% раствора гидроксида аммония.
37. Определить массовую долю сульфата железа (II) в растворе, полученном растворением 41,7 г железного купороса FeSO4·7H2O в 258,3 г воды.
38. Определить молярную концентрацию раствора, полученного при смешении 200 мл 8 М и 300 мл 2 М растворов серной кислоты.
39. Определить массовую долю 8 М раствора соляной кислоты, плотность которого равна 1,23 г/мл.
40. Смешано 100 г 8% и 300г 5% раствора одного и того же вещества. Определить массовую долю вещества в полученном растворе.
41. В лаборатории имеется раствор с массовой долей гидроксида натрия 30%, плотность которого 1,33 г/мл. Какой объем этого раствора надо взять для приготовления раствора объемом 250 мл с массовой долей гидроксида натрия 14% и плотностью 1,15 г/мл?
42. К раствору массой 400 г, массовая доля соли в которой составляет 20%, прилили 100 мл воды. Приняв плотность воды равной 1,0 г/мл, определить массовую долю соли в полученном растворе.
43. Какую массу раствора с массовой долей карбоната калия 40% надо прибавить к воде массой 500 г для получения раствора с массовой долей K2CO3 5%?
44. Сколько граммов CuSO4содержится в 10,0 мл 0,2 М раствора? Какова нормальность этого раствора?
45. Сколько граммов BaCl2 содержится в 25,0 мл 0,5 н раствора? Каков его титр?
46. Вычислить массовую долю вещества врастворе, полученном растворением 50 г вещества в 1,5 л воды.
47. Сколько миллилитров 60% раствора серной кислоты, плотность которого 1,50 г/мл, нужно взять, чтобы приготовить 5,0 л 12% раствора, плотность которого 1,08 г/мл?
48. Сколько миллилитров 30% раствора гидроксида калия, плотность которого 1,29 г/мл, нужно взять, чтобы приготовить 3,0 л 0,50 М раствора?
49. Сколько миллилитров 70% раствора нитрата калия, плотность которого 1,6 г/мл, нужно взять, чтобы приготовить 0,5 л 0,2 нраствора?
50. До какого объема нужно разбавить 20,0 мл 20% раствора хлорида меди (II), плотность которого 1,20 г/мл, чтобы получить 0,05 М раствор?
51. Сколько воды нужно прибавить к 25,0 мл 40% раствора гидроксида калия, плотность которого 1,41 г/мл, чтобы получить 2% раствор?
52. К 500 мл раствора соляной кислоты, плотность которого 1,1 г/мл, прибавили 2,50 л воды, после чего раствор стал 4%. Вычислить массовую долю HClв исходном растворе.
53. Сколько миллилитров 1,5 н раствора некоторого вещества нужно прибавить к 2 л 0,1 н раствора того же вещества, чтобы получить 0,2 н раствор?
54. Вычислить молярную концентрацию 10% раствора азотной кислоты, плотность которого 1,056 г/мл.
55. Вычислить молярную концентрацию20% раствора хлорида цинка, плотность которого 1,186 г/мл.
56. К 20,0 мл 16% раствора сульфата марганца (II), плотность которого 1,17 г/мл, прибавили 20,0 мл 10% раствора гидроксида калия, плотность которого 1,08 г/мл. Какое вещество взято в избытке и сколько граммов его останется после реакции?
57. К 10 мл 12,8% раствора хлорида бария, плотность которого 1,12 г/мл, прибавлен избыток раствора сульфата натрия, в результате чего выпал осадок сульфата бария. Вычислить массу осадка.
58. Сколько миллилитров 0,2 М раствора Na2CO3 требуется для реакции с 50,0 мл 0,5 М раствора СаСl2?
59. Для реакции с FeCl3, содержащимся в 25 мл 2,0 М раствора, взято 100мл 1,0 М раствора КОН. Какое вещество взято в избытке.
60. Сколько миллилитров 0,50 н раствора щелочи требуется, чтобы осадить в видеСu(OH)2 всю медь, содержащуюся в 15 мл 1,2 н раствора CuCl2?
61. Какой объем раствора с массовой долей карбоната натрия 15% (плотность 1,16 г/мл) надо взять для приготовления раствора 0,45 М карбоната натрия объемом 120 мл?
62. К раствору 3,5 М хлорида аммония объемом 30 мл и плотностью 1,05г/мл прилили 40 мл воды (плотность воды 1,00 г/мл). Определите массовую долю соли в полученном растворе.
63. Сколько мл 25% раствора серной кислоты (r = 1,18 г/мл) следует взять для приготовления 250 мл 1М раствора?
64. Сколько мл раствора хлороводородной кислоты с массовой долей HCl 30% (r = 1,15 г/мл) необходимо для приготовления 500 мл 1М раствора?
65. Сколько мл воды следует добавить к 361,1 мл 12% раствора нитрата серебра (r = 1,108 г/мл), чтобы приготовить 5% раствор?
66. В каком объеме воды необходимо растворить 57,4 г ZnSO4 . × 7Н2О, чтобы приготовить 8% раствор сульфата цинка?
67. Сколько граммов хлорида натрия следует добавить к 200 г 8%раствора хлорида натрия, чтобы приготовить 18% раствор?
68. Определите массовую долю HCl в растворе, полученном при растворении 33,6 л HCl (н.у.) в 712,2 мл 5% раствора соляной кислоты (r = 1,025 г/мл).
69. Определите массовую долю соли в растворе, полученном после полного растворения 125 г медного купороса (CuSO4. 5Н2О) в 250 г 5% раствора сульфата меди (II).
70. Сколько граммов фосфата натрия надо добавить к 6 л воды, чтобы устранить общую жесткость, равную 6,7ммольэкв/л?
71. Вычислить временную жесткость воды, зная, что на реакцию с гидрокарбонатами, содержащимся в 100 мл этой воды, потребовалось 15 мл 0,1н раствора соляной кислоты.
72. Жесткость воды, содержащей только гидрокарбонат магния, равна 1,625ммольэкв/л. Определите массу гидрокарбоната магния в 1 л воды.
73. На осаждение карбонатов из 500 мл воды израсходовали 0,53 г соды (карбоната натрия). Определить жесткость воды.
74. Определить жесткость воды, в 20 л которой содержится 4,44 г хлорида кальция.
75. Сколько граммов гидроксида кальция необходимо прибавить к 1000 л воды, чтобы удалить временную жесткость, равную 2,86 ммольэкв/л?
76. Вычислить временную жесткость воды, зная, что на реакцию с гидрокарбонатами, содержащимся в 100 мл этой воды, потребовалось 5 мл 0,1н раствора соляной кислоты.
77. Чему равна временная жесткость воды, в 1 л которой содержится 0,146 г гидрокарбоната магния?
78. Жесткость воды, содержащей только гидрокарбонат кальция, равна 1,785 ммольэкв/л. Определите массу гидрокарбоната кальция в 1 л воды.
79. Сколько граммов карбоната натрия надо добавить к 5 л воды, чтобы устранить общую жесткость, равную 4,6 ммольэкв/л?
80. В 1 литре воды содержится 38 мг ионов Mg2+ и 108 мг ионов Ca2+.
Вычислить общую жесткость воды.
81. При осаждении гидрокарбонатов из 1 л воды израсходовали 0,37 г гашеной извести (гидроксида кальция). Определить временную жесткость воды.
82. При осаждении карбонатов из 1 л воды израсходовали 0,265 г соды (карбоната натрия).Определите жесткость воды.
83. Определите жесткость воды, в 5 л которой содержится 2,22 мг хлорида кальция.
84. Найдите временную жесткость воды, если на титрование 0,1 л образца воды, содержащей гидрокарбонат магния, израсходовано 7,2мл 0,13н соляной кислоты.
85. Чему равна жесткость воды, содержащей 0,005 моль/лхлорида кальция?
86. Жесткость некоторого образца воды обусловливается только гидрокарбонатом железа(II). При кипячении 0,25 л такой воды в осадок выпадает 4 мг карбоната железа(II).Чему равна жесткость воды?
87. Чему равна жесткость воды, содержащей 0,006 моль/л хлорида магния?
88. Чему равна жесткость воды, содержащей 0,010 моль/л хлорида железа (III)?
89. Найдите временную жесткость воды, если на титрование 0,1 л образца воды, содержащей гидрокарбонат кальция, израсходовано 8,2 мл 0,15н соляной кислоты.
90. В 1 литре воды содержится 48 мг ионов Mg2+,120 мг ионов Ca2+ и 56мг ионов Fe3+.Вычислить общую жесткость воды.
Лабораторная работа № 3. ОПРЕДЕЛЕНИЕ ЭНТАЛЬПИИ РЕАКЦИИ НЕЙТРАЛИЗАЦИИ СИЛЬНОЙ КИСЛОТЫ СИЛЬНЫМ ОСНОВАНИЕМ
3.1. Цель работы
Выполнение калориметрических измерений и термодинамических расчетов, связанных с энергетикой химических реакций.
3.2. Объекты и средства исследования: калориметр, термометр, мешалка с электроприводом, коническая воронка, 1М растворы хлористоводородной кислоты и гидроксида натрия.
3.3. Программа работы.
3.3.1.Взвесить сухой калориметрический стакан (с точностью до 0,1 г).
3.3.2.Собрать калориметрическую установку (рис.1) и через воронку налить в сосуд 75 мл 1М раствора щелочи; записать температуру раствора щелочи Тщ с точностью до 0,1 К.
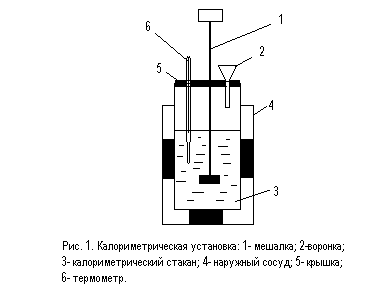
3.3.3. Налить в мерный цилиндр такой же объем 1М раствора кислоты и измерить температуру раствора Тк с той же точностью. Начальная температура смеси кислоты и щелочи Т1 – среднее арифметическое от Тщ и Тк.
3.3.4. При работающей мешалке через воронку быстро влить кислоту в калориметрический стакан и отметить самую высокую температуру Т2, которую покажет термометр после сливания растворов.
3.3.5. Данные опыта свести в таблицу 1.
Таблица 1.
| Масса калоримет- рического стакана, m1, г | Суммарный объем жидкости в стакане, V, мл | Температура, К | ||||
| Тщ | Тк | Т1 | Т2 | DТ=Т2-Т1 | ||
3.3.6. По полученным данным определить:
а) разницу температурDТ
б) массу жидкости в калориметрическом стакане, m2(при расчете считать плотность жидкости равной единице)
в) теплоемкость системы
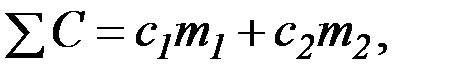 где
где
с1 = 0,75.103 Дж/(кг×К) – удельная теплоемкость стекла,
с2 = 4,18. 103 Дж/(кг×К) – удельная теплоемкость раствора.
г) количество теплоты, выделившееся при реакции:
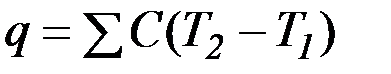
д) число моль нейтрализованной кислоты (щелочи) или число моль полученной воды (n)
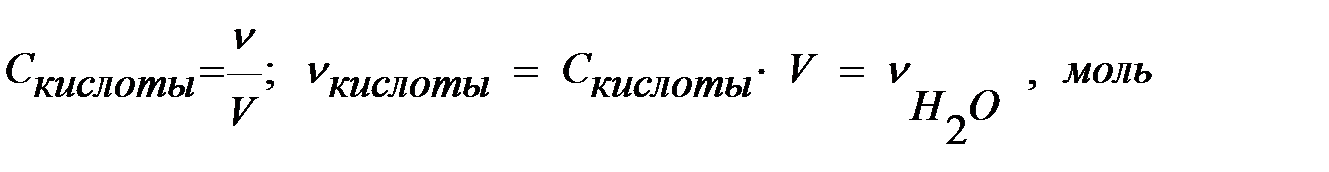
е) теплоту нейтрализации 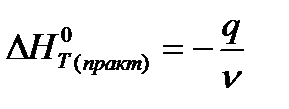

 (кДж/моль H2O)
(кДж/моль H2O)
3.3.7. Используя справочные данные, рассчитать теоретическое значение теплоты реакции (ΔH0теор)
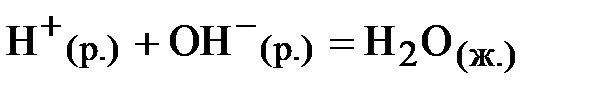
и относительную ошибку эксперимента, которая не должна превышать 5%.
3.4. Контрольные вопросы
Установить термодинамическую возможность протекания химического процесса при стандартном состояниии область температур, при которых протекание химической реакции возможно. Для решения используйте таблицу термодинамических функций веществ.
1. 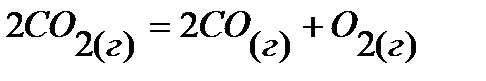
2. 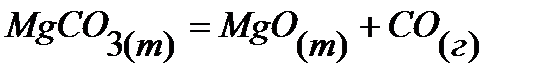
3. 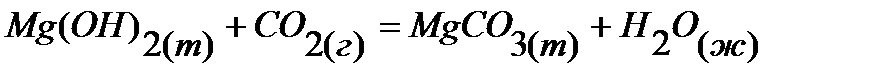
4. 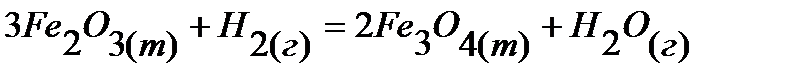
5. 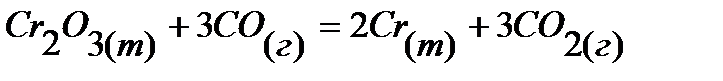
6. 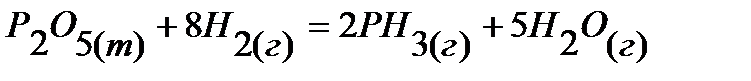
7. 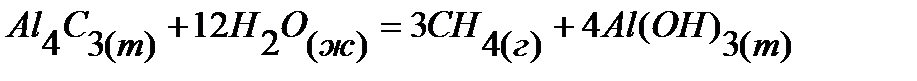
8. 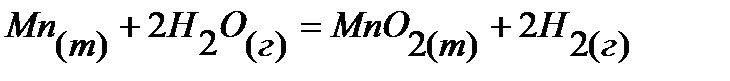
9. 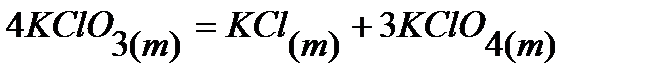
10. 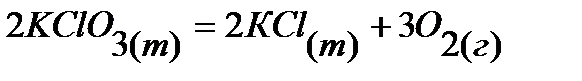
11. 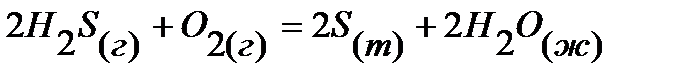
12. 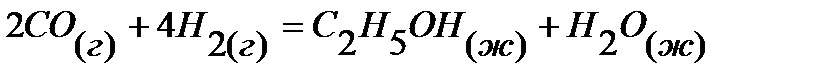
13. 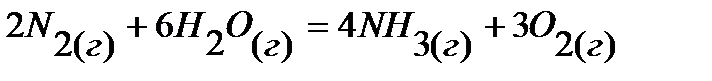
14. 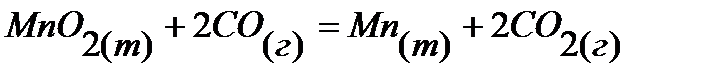
15. 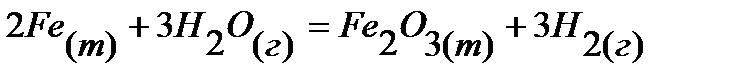
16. 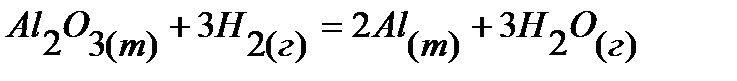
17. 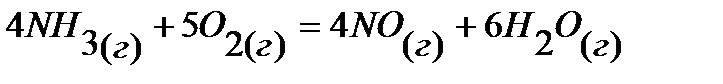
18. 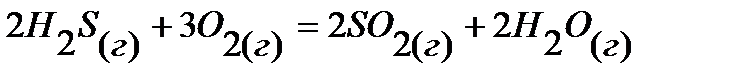
19. 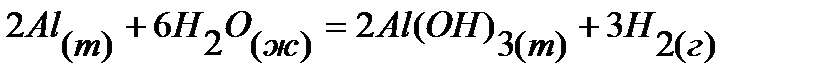
20. 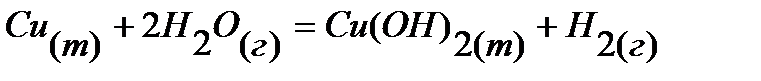
21. 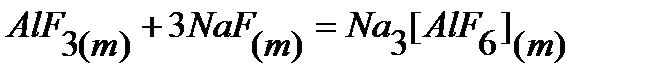
22. 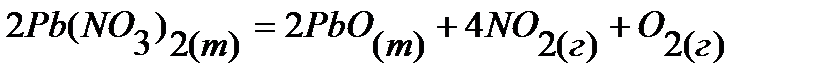
23. 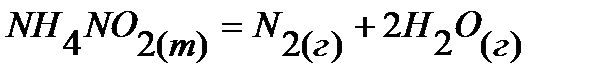
24. 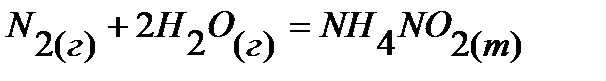
25. 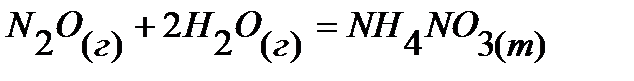
26. 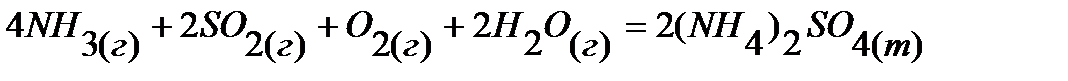
27. 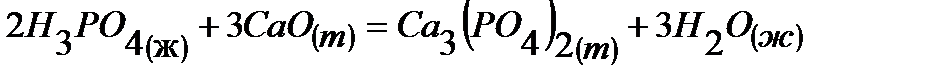
28. 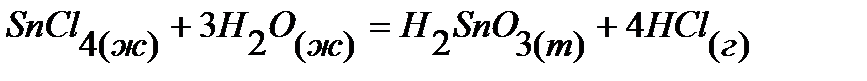
29. 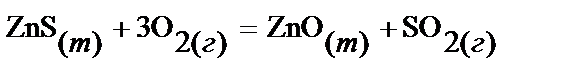
30. 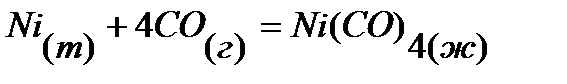
31. 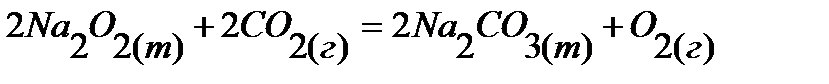
32. 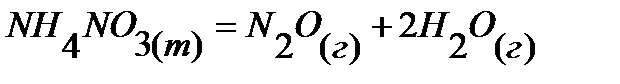
33. 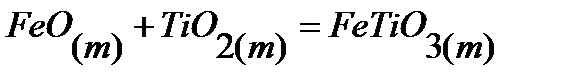
34. 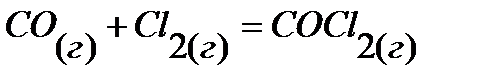
35. 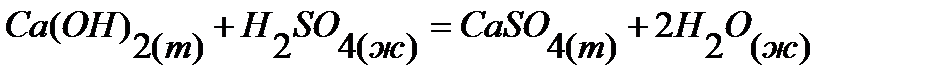
36. 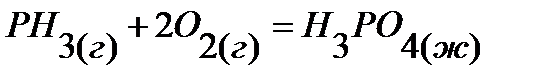
37. 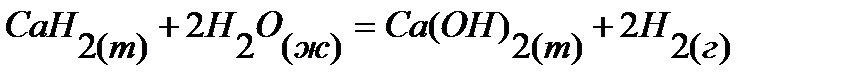
38. 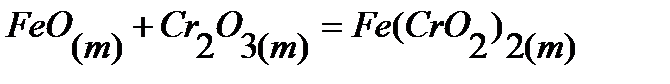
39. 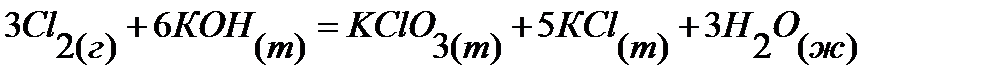
40. 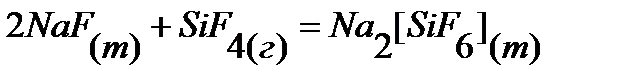
41. 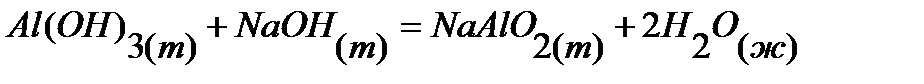
42. 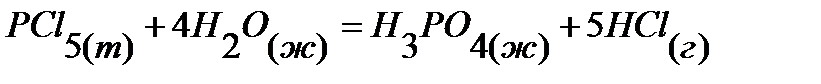
43. 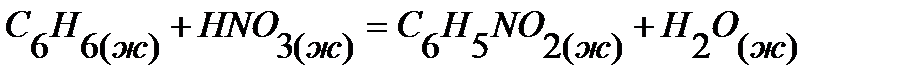
44. 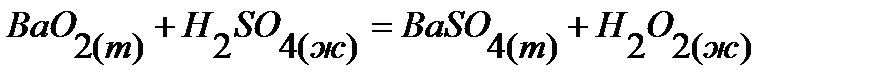
45. 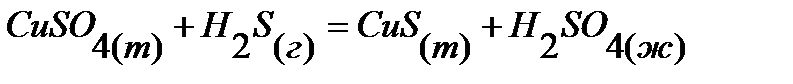
46. 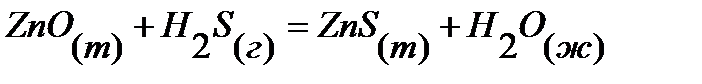
47. 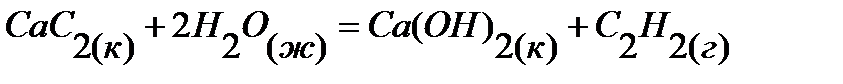
48. 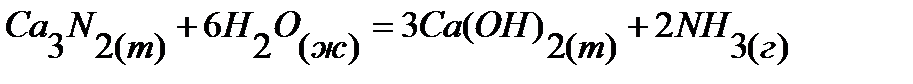
49. 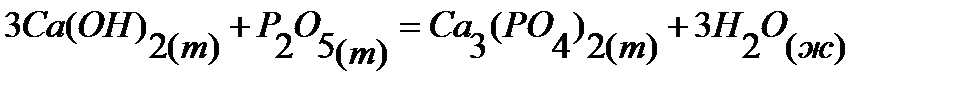
50. 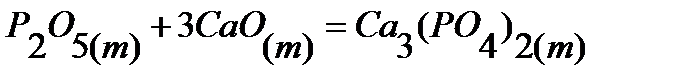
51. 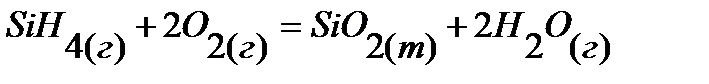
52. 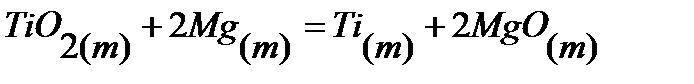
53. 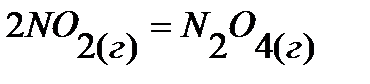
54. 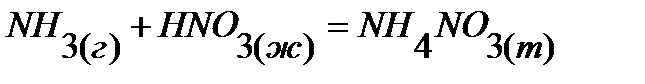
55. 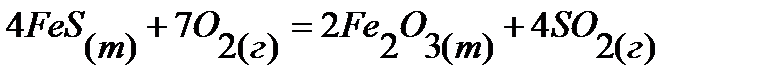
56. 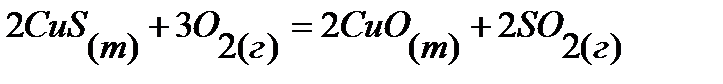
57. 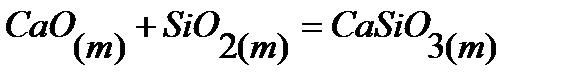
58. 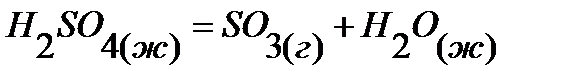
59. 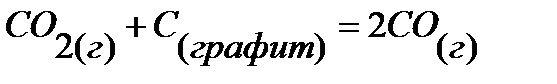
60. 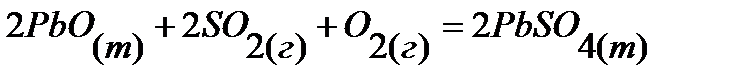
61. 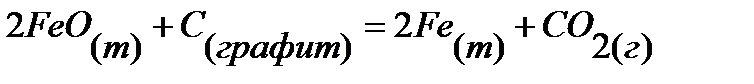
62. 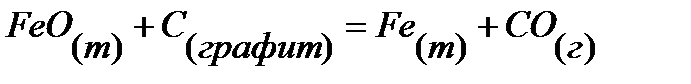
63. 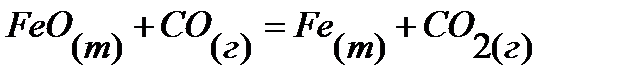
64. 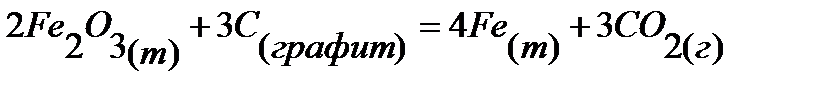
65. 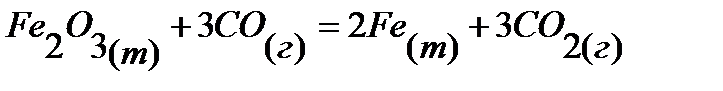
66. 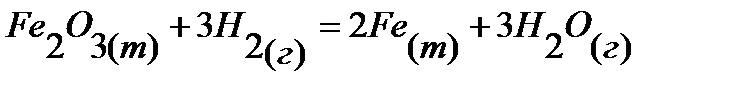
67. 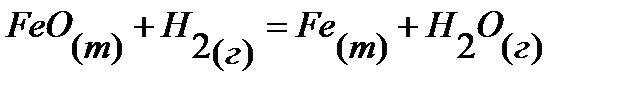
68. 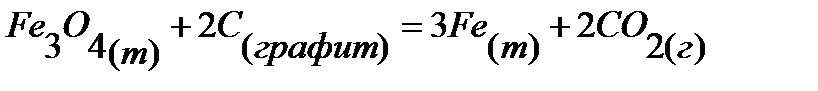
69. 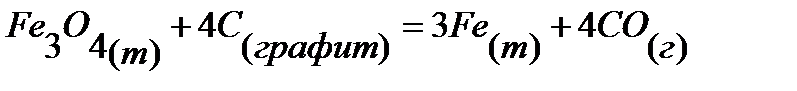
70. 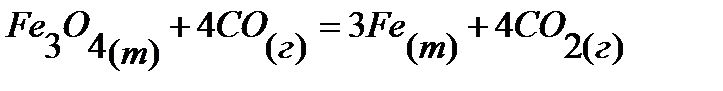
71. 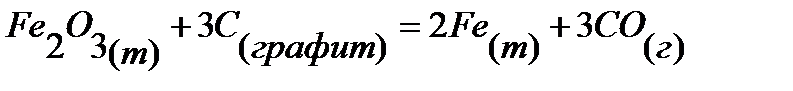
72. 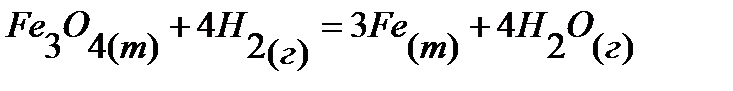
73. 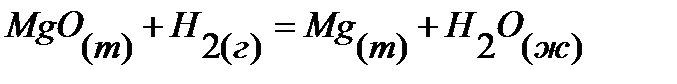
74. 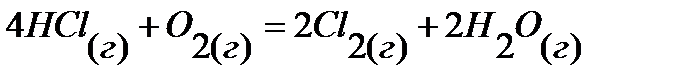
75. 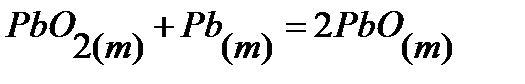
76. 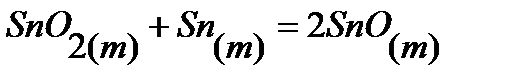
77. 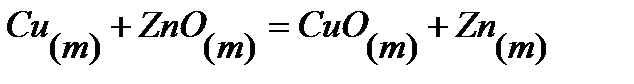
78. 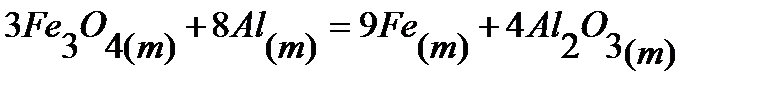
79. 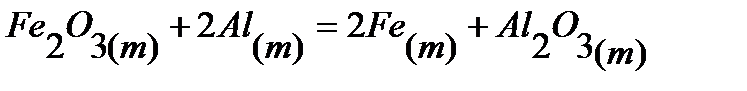
80. 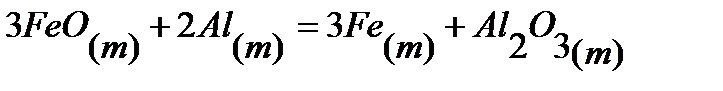
81. 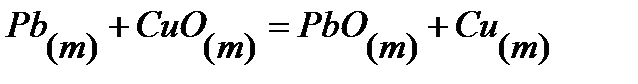
82. 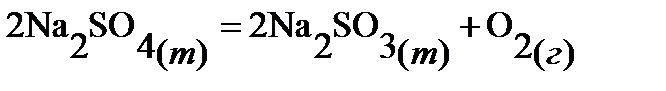
83. 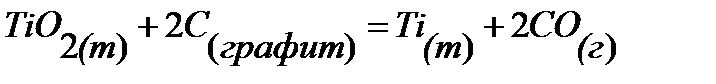
84. 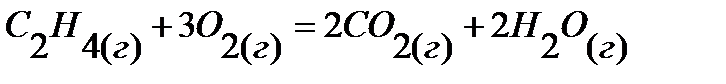
85. 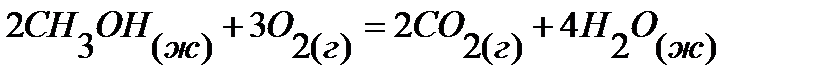
86. 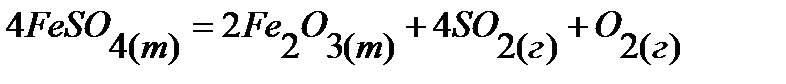
87. 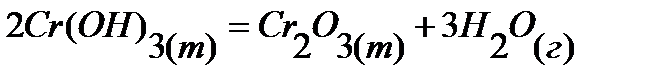
88. 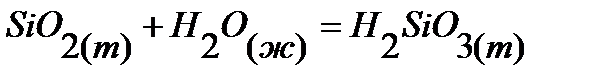
89. 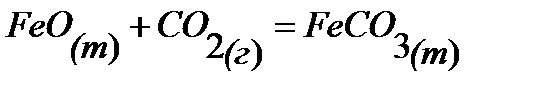
90. 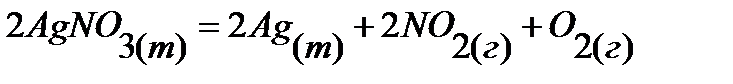
91. 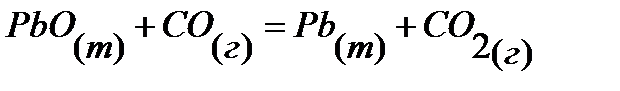
92. 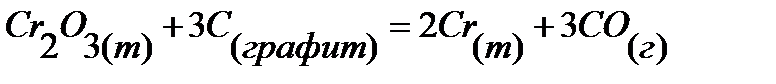
93. 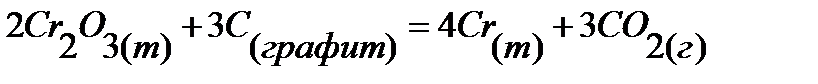
94. 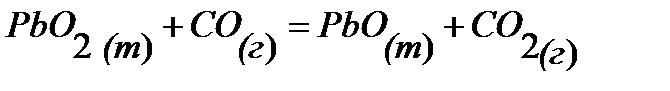
95. 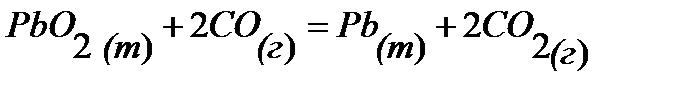
96. 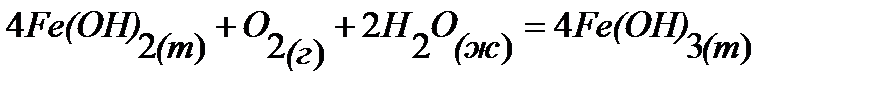
97. 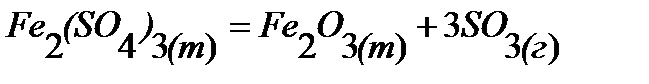
98. 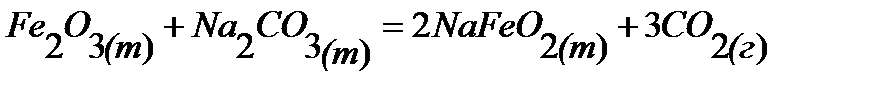
99. 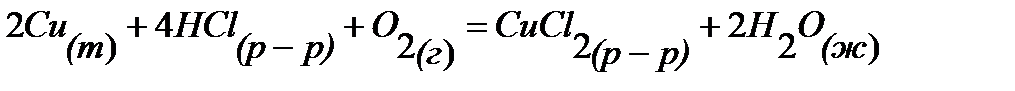
100. 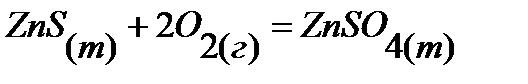
Таблица 2.
Стандартные энтальпии образования (ΔН0298) и энтропии (S0298)
некоторых веществ
| Вещество | ΔН0298, 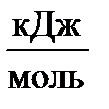 | S0298, 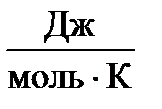 |
| Ag(т) | 42,6 | |
| AgNO3(т) | -124,5 | 140,9 |
| Al (т) | 27,3 | |
| Al2O3(т) | -1672,0 | 50,9 |
| AlF3(т) | -1422,7 | 63,1 |
| Al4C3(т) | -209,0 | 89,0 |
| Al(OH)3(т) | -1237,9 | 81,0 |
| BaO2(т) | -629,7 | 65,7 |
| BaSO4(т) | -1465,0 | 132,0 |
| С(графит) | 5,7 | |
| CH4(г) | -74,8 | 186,2 |
| С2Н2 (г) | 226,8 | 200,8 |
| С6Н6(ж) | 82,6 | 269,2 |
| С6Н5NO2(ж) | 16,0 | 225,1 |
| С2Н4 (г) | 52,3 | 219,5 |
| CH3OH(ж) | -238,6 | 126,8 |
| C2H5OH(ж) | -277,6 | 160,7 |
| CO(г) | -110,5 | 197,5 |
| СО2(г) | -393,5 | 213,7 |
| СОСl2(г) | -214,2 | 281,0 |
| CaCO3(т) | -1207,0 | 88,7 |
| СаН2(т) | -182,4 | 42,1 |
| Са3N2(т) | -431,8 | 105,0 |
| СаО(т) | -635,5 | 39,7 |
| СаС2(т) | -57,6 | 67,8 |
| Са(ОН)2(т) | -986,6 | 76,1 |
| Са3(РО4)2(т) | -4142,0 | 231,6 |
| CaSiO3(т) | -1599,9 | 83,9 |
| СaSO4(т) | -1338,0 | 102,4 |
| Cl2(г) | 222,9 | |
| Сu(т) | 32,1 | |
| Сu2+ | 67,0 | 92,8 |
| Вещество | ΔН0298, 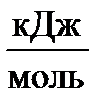 | S0298, 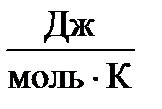 |
| CuO(т) | -149,6 | 41,2 |
| Cu(OH)2(т) | -450,2 | 80,4 |
| СuCl(т) | -137,3 | 87,0 |
| СuS(к) | -49,6 | 41,3 |
| CuSO4(т) | -753,0 | 101,8 |
| Cr(OH)3(т) | -1000,0 | 80,3 |
| Cr2O3(т) | -1140,6 | 81,2 |
| Cr(т) | 23,6 | |
| Fe(т) | 26,8 | |
| FeO(т) | -264,8 | 60,8 |
| Fe2O3(т) | -812,2 | 87,4 |
| Fe3O4(т) | -1117,1 | 146,2 |
| Fe(OН)2(т) | -561,7 | 88,0 |
| Fe(OН)3(т) | -826,6 | 105,0 |
| FeS(т) | -100,4 | 60,3 |
| FeSО4(т) | -929,5 | 121,0 |
| Fe2(SО4)3(т) | -2584,0 | 282,8 |
| Fe(CrO2)2(т) | -5,3 | 140,4 |
| FeTiO3(т) | -1239,0 | 102,2 |
| FeCO3(т) | -738,2 | 95,4 |
| H2(г) | 130,5 | |
| H+(р) | ||
| HCl(г) | -270,7 | 206,5 |
| Cl- | -233,6 | 153,2 |
| Н2О(г) | -241,8 | 188,6 |
| Н2О(ж) | -285,8 | 70,1 |
| Н2О2(ж) | -187,8 | 109,5 |
| H2S(г) | -210,8 | 205,7 |
| HNO2(ж) | -79,8 | 247,3 |
| HNO3(ж) | -129,2 | 253,1 |
| Н2SO4(ж) | -814,2 | 156,9 |
| Н2SiO3(т) | -1188,7 | 134,0 |
| Н2SnO3 | -992,2 | 83,6 |
| KOH(т) | -425,8 | 79,3 |
| KCl(т) | -435,9 | 82,6 |
| KClO3(т) | -391,2 | 143,0 |
| KClO4(т) | -414,8 | 146,6 |
| Вещество | ΔН0298, 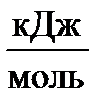 | S0298, 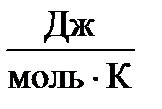 |
| Mg(т) | 28,2 | |
| Mg(OH)2(т) | -885,6 | 60,9 |
| MgCl2(т) | -641,1 | 89,9 |
| MgCO3(т) | -1060,0 | 63,4 |
| Mg3N2(т) | -461,1 | 87,9 |
| MgO(т) | -601,8 | 26,9 |
| MnO2(т) | -498,2 | 51,4 |
| Mn(т) | 30,8 | |
| N2(г) | 191,5 | |
| NH3(г) | -46,2 | 192,6 |
| NH4NO2(т) | -256,0 | 116,8 |
| NH4NO3(т) | -365,4 | 151,0 |
| N2O(г) | 82,0 | 219,9 |
| NO(г) | 90,3 | 210,6 |
| NO2(г) | 33,5 | 240,2 |
| N2O4(г) | 9,6 | 303,8 |
| (NH4)2SO4(т) | -1183,9 | 220,9 |
| NH4Cl(т) | -314,2 | 95,8 |
| NaAlO2(т) | -1137,4 | 67,6 |
| Na2O2(т) | -492,8 | 91,9 |
| Na3AlF6(т) | -3059,2 | 228,4 |
| NaCl(т) | -394,8 | 69,8 |
| NaClO3(тк) | -365,4 | 129,7 |
| NaF(т) | -546,8 | 49,4 |
| Na2CO3(т) | -1086,8 | 130,4 |
| Na2SiF6(т) | -2724,6 | 205,6 |
| Na2SO4(т) | -1342,4 | 143,2 |
| NaOH(т) | -409,8 | 62,2 |
| Ni(т) | 29,9 | |
| Ni(CO)4(ж) | -579,4 | 384,5 |
| О2(г) | 205,0 | |
| ОН-(р) | -230,2 | 10,9 |
| Р2О5(т) | -1492,0 | 114,5 |
| PCl5(ж) | -443,4 | 302,9 |
| Н3РО4(ж) | -1212,0 | 106,2 |
| РН3(г) | 16,8 | 202,3 |
| Рb(т) | 64,8 |
| Вещество | ΔН0298, 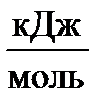 | S0298, 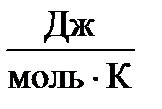 |
| РbO(т) | -219,3 | 66,1 |
| Pb(NO3)2(т) | -429,8 | 204,1 |
| PbSO4(т) | -878,5 | 21,2 |
| PbO2(т) | -276,6 | 74,9 |
| S(т) | 30,7 | |
| SO2(г) | -297,0 | 248,1 |
| SO3(г) | -395,8 | 256,7 |
| SiF4(г) | -1614,9 | 282,6 |
| SiCl4(ж) | -687,8 | 239,7 |
| SiH4(г) | 34,7 | 204,6 |
| SiO2(т) | -910,0 | 41,8 |
| Sn(т) | 51,6 | |
| SnО(т) | -286,0 | 56,5 |
| SnCl4(ж) | -421,7 | 247,6 |
| Ti(т) | 30,6 | |
| TiCl4(ж) | -804,2 | 252,4 |
| TiO2(т) | -943,7 | 50,3 |
| ZnSO4(т) | -936,5 | 123,8 |
| ZnO(т) | -350,6 | 43,6 |
| ZnS(т) | -193,2 | 45,7 |
| Zn(NO3)2(т) | -456,9 | 185,5 |
Лабораторная работа № 4. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
 2015-10-14
2015-10-14 4721
4721







