11.1. Цель и задачи работы
Изучить влияние различных факторов на коагуляцию коллоидных растворов. Ознакомиться с механизмами медленной и быстрой коагуляции.
11.2. Теоретические сведения
Устойчивость коллоидных систем - это постоянство их свойств во времени. Существует два вида устойчивости:
- устойчивость к осаждению частиц дисперсной фазы.
- устойчивость к агрегации частиц дисперсной фазы.
Первый вид устойчивости характеризует способность дисперсной системы сохранять равномерное распределение частиц дисперсной фазы по объему дисперсионной среды (седиментационная устойчивость).
Второй тип устойчивости - агрегативная устойчивость, то есть устойчивость системы к укрупнению частиц и снижению поверхностной энергии.
Все дисперсные системы можно условно разделить на лиофильные, которые получают при самопроизвольном диспергировании одной из фаз, и лиофобные, которые получают в результате диспергирования или конденсации.
Лиофобные системы обладают избытком поверхностной энергии, если она не скомпенсирована введением стабилизаторов. Поэтому в них самопроизвольно идут процессы укрупнения частиц. Такие системы называют агрегативно неустойчивыми.
Различают два механизма укрупнения частиц. По первому механизму укрупнение частиц происходит за счет переноса вещества от мелких частиц к крупным частицам. Такой перенос вещества называется изотермической перегонкой.
По второму механизму укрупнение частиц происходит за счет слипания частиц - коагуляции. Коагуляция в разбавленных системах приводит к потере седиментационной устойчивости и к расслоению фаз. В концентрированных системах коагуляция может проявляться в образовании объемной структуры.
Агрегативная устойчивость нестабилизированных лиофобных систем носит кинетический характер, и судить о ней можно по скорости процессов, вызываемых избытком поверхностной энергии.
Агрегативная устойчивость может носить и термодинамичекий характер. Различают термодинамически агрегативно устойчивые системы и системы, термодинамически устойчивые к коагуляции. Лиофильные системы термодинамически агрегативно устойчивы, для них процесс коагуляции не характерен. Лиофобные стабилизированные системы термодинамически устойчивы к коагуляции, но они могут быть выведены из такого состояния с помощью воздействий, приводящих к избытку поверхностной энергии.
Факторы устойчивости дисперсных систем.
1. Электростатический фактор: уменьшение поверхностного натяжения происходит вследствие возникновения на поверхности частиц дисперсной фазы двойного электрического слоя.
2. Адсорбционно-сольватный: уменьшение поверхностного натяжения происходит вследствие взаимодействия частиц дисперсной фазы со средой.
3. Энтропийный фактор: проявляется в системах, частицы которых принимают участие в броуновском движении, выражается в стремлении дисперсной фазы к равномерному распределению по объему.
4. Структурно-механический: на поверхности частиц имеются пленки, разрушение которых требует затраты энергии и времени.
5. Гидродинамический: проявляется в снижении скорости коагуляции, благодаря изменению вязкости среды.
6. Смешанные факторы.
Скорость коагуляции может быть различна: от нескольких секунд до нескольких суток, месяцев, лет.
Коагуляция коллоидных систем может быть вызвана разными причинами: изменением температуры, механическим воздействием, влиянием света, ультразвука. Одним из способов изменения агрегативной устойчивости дисперсных систем, особенно золей, является введение электролитов. Электролиты в состоянии изменить структуру двойного электрического слоя и его диффузный слой.
Коагуляция зависит от природы и концентрации электролитов. Минимальная концентрация электролита, вызывающая коагуляцию дисперсных систем, называется порогом коагуляции.
на основании многочисленного опытного материала можно сформулировать основные правила коагуляции золей электролитами:
1) Коагуляцию вызывает ион, заряженный противоположно ядру мицеллы.
2) Чем больше валентность иона, тем меньше порог коагуляции - первое правило Шульце-Гарди.
3) Для ионов одной валентности - чем больше масса иона, тем меньше порог коагуляции - второе правило Шульце-Гарди.
Защитить золь от коагуляции электролитами можно, вводя в него вещества, создающие на поверхности ядра защитную пленку.
Хорошее защитное действие оказывают растворы высокомолекулярных соединений, например, желатин.
Количество мг стабилизатора, необходимое для предотвращения коагуляции 10 мл золя, называется защитным числом S:
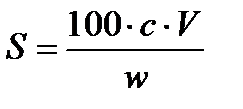 (11.1),
(11.1),
где C - молярная концентрация электролита, вызывающего коагуляцию, моль/л, V - объем желатина, который требуется для защиты, мл, w - объем защищаемого золя, мл.
11.3.Объекты и средства исследования: штативы с пробирками на 20 мл, электрическая плитка, 2% водный растворхлорида железа (III), 0,1н растворыхлорида натрия, сульфата натрия, гескацианоферрата (III) натрия, желатин, стакан на 250 мл, коническая плоскодонная колба на 250 мл, пипетки на 10 мл и на 1-2 мл, градуированные бюретки.
11.4. Программа работы
11.4.1. Подготовка к работе
11.4.1.1. В стакан емкостью 250 мл налить 100 мл дистиллированной воды. Нагреть до кипения.
11.4.1.2. В воду при помешивании ввести по каплям 15-20 мл раствора хлорида железа (III).
11.4.1.3. Полученный раствор кипятить 2 минуты для завершения гидролиза соли.
FeCl3 + 3H2O = Fe(OH)3 + 3HCl
При этом раствор приобретает цвет крепко заваренного чая. Однако выпадения гидроксида железа не происходит, так как образуется коллоидный раствор.
Строение мицеллы гидроксида железа (III):
[mžFe(OH)3žnFe3+(n-x)žCl-]x-žxCl-,
где ионы железа являются потенциалопределяющими.
11.4.1.4. Заполнить бюретки растворами электролитов: NaCl, Na2SO4, K3[Fe(CN)6]
11.4.2. Коагуляция электролитами.
Налить в 3 пробирки по 5 мл гидрозоля хлорида железа (III). По каплям прибавить из бюреток растворы электролитов. Заполнить таблицу:
Таблица 1. Определение коагулирующей способности электролитов.
| Реактив, V, мл | Объем электролита до помутнения, V, мл | ||
| гидрозоль железа (III) | 0,1н хлорид натрия | 0,1н сульфат натрия | 0,1н гексацианоферрат(III) калия |
| 5 мл |
Сделать вывод, какой электролит обладает лучшим коагулирующим действием в соответствии с правилом Шульца-Гарди.
11.4.3. Нахождение защитного числа желатина.
Установить исходную концентрацию защитного вещества, для чего приготовить раствор 50 мг желатина в 100 мл воды и провести предварительные испытания пригодности этой концентрации.
Две пробирки заполнить 5 мл золя, в первую добавить 4,5 мл воды и 0,5 мл раствора желатина, а во вторую - 5 мл раствора желатина. Затем в пробирки ввести 0,1н раствор сульфата натрия в таком объеме, который вызвал помутнение золя в п.10.4.2.
Если золь помутнел при этом в обеих пробирках, следовательно, концентрация исходного раствора желатина мала, нужно приготовить раствор стабилизатора большей концентрации.
Если золь не помутнел ни в одной пробирке, значит, желатин слишком концентрированный.
Если в первой пробирке золь помутнел, а во второй остался светлым, то исходный раствор желатина можно применять для определения защитного числа.
Таблица 2. Определение защитного числа желатина.
| № п/п | ||||||||||
| Золь, мл | ||||||||||
| Вода, мл | 0,0 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 | 5,0 |
| Желатин, мл | 5,0 | 4,5 | 4,0 | 3,5 | 3,0 | 2,5 | 2,0 | 1,5 | 1,0 | 0,5 |
| Электролит, мл | ||||||||||
| Общий объём, мл | ||||||||||
| Помутнение |
По формуле (11.1) определить защитное число желатина.
Сделать выводы по работе.
11.5. Контрольные вопросы
Согласно своему варианту (см.таблицу):
11.5.1. Напишите уравнение реакции образования гидрозоля С из веществ А и В.
11.5.2. Напишите формулу мицеллы образовавшегося гидрозоля С при условии, что вещество А взято в избытке. Укажите знак заряда коллоидной частицы.
11.5.3. Укажите электролит-коагулятор, обладающий меньшим порогом коагуляции.
| № | А (изб.) | в | С | Электролит-коагулятор |
| NaJ | AgNO3 | AgJ | NaF, Ca(NO3)2, K2SO4 | |
| MgCl2 | NaOH | Mg(OH)2 | K3PO4, (CH3COO)2Zn, AlCl3 | |
| NH4CNS | AgNO3 | AgCNS | KNO3, Na2SO4, Ca(NO3)2 | |
| CaCl2 | H2SO4 | CaSO4 | ZnCl2, AlCl3, K2SO4 | |
| BaCl2 | K2SO4 | BaSO4 | NH4Cl, AlCl3, K3[Fe(CN)6] | |
| (NH4)2S | AgNO3 | Ag2S | Ba(NO3)2, CH3COOK, Na2SO4 | |
| AlCl3 | NaOH | Al(OH)3 | Na2SO4, KNO3, CaCl2 | |
| CrCl3 | NH4OH | Cr(OH)3 | K2SO4, Al(NO3)3, BaCl2 | |
| Na2SiO3 | HCl | H2SiO3 | K2SO4, (CH3COO)2Zn, AlCl3 | |
| ZnCl2 | (NH4)2S | ZnS | (NH4)2SO4, Ca(NO3)2, K3[Fe(CN)6] | |
| MnCl2 | (NH4)2S | MnS | K2SO4, Al(NO3)3, CaCl2 | |
| FeCl3 | NaOH | Fe(OH)3 | Na2SO4, KNO3, BaCl2 | |
| K2SO4 | Ba(NO3)2 | BaSO4 | NH4Cl, AlCl3, K3[Fe(CN)6] | |
| CoCl2 | (NH4)2S | CoS | ZnCl2, AlCl3, K2SO4 | |
| NiCl2 | (NH4)2S | NiS | KNO3, Na2SO4, Ca(NO3)2 | |
| CdCl2 | H2S | CdS | (NH4)2SO4, Ca(NO3)2, Al(NO3)3 | |
| AgNO3 | KJ | AgJ | NaF, Ca(NO3)2, K2SO4 | |
| FeCl3 | K4[Fe(CN)6] | Fe4[Fe(CN)6]3 | CH3COONa, K2SO4, Al(NOs)3 | |
| Zn(NO3)2 | NaOH | Zn(OH)2 | Na2SO4, KCl, BaCl2 | |
| K2CrO4 | AgNO3 | Ag2CrO4 | NH4Cl, AlCl3, K3[Fe(CN)6] | |
| Pb(NO3)2 | KJ | PbJ2 | (NH4)2SO4, CaCl2, Al(NO3)3 | |
| Cd(NO3)2 | NaOH | Cd(OH)2 | Na2SO4, KCl, BaCl2 | |
| Zn(NO3)2 | K3[Fe(CN)6 ] | Zn3[Fe(CN)6]2 | CH3COONa, K2SO4, BaCl2 | |
| K4[Fe(CN)6] | FeCl3 | Fe4[Fe(CN)6]3 | ZnCl2, AlCl3, K2SO4 | |
| (NH4)2S | Pb(NO3)2 | PbS | K2SO4, (CH3COO)2Zn, AlCl3 | |
| AgNO3 | (NH4)2C2O4 | Ag2C2O4 | CH3COONa, K2SO4, Al(NO3)3 | |
| Hg(NO3)2 | H2S | HgS | Na2SO4, KNO3, BaCl2 | |
| FeSO4 | K3[Fe(CN)6 ] | Fe3[Fe(CN)6]2 | (NH4)2SO4, CaCl2, Al(NO3)3 | |
| Na3AsO4 | AgNO3 | Ag3AsO4 | NH4Cl, AlCl3, K3[Fe(CN)6] | |
| (NH4)2S | CuSO4 | CuS | NaF, Al(NO3)3, K2SO4 |
 2015-10-14
2015-10-14 3576
3576
