1. Какие вещества называют простыми? Сложными? Из приведенных веществ выберите простые: СО, О3, СаО, К, Н2, Н2О.
2. Какие вещества называют оксидами? Кислотами? Основаниями? Солями?
3. Из приведенных оксидов – SO2, CaO, ZnO, Cr2O3, CrO, P2O5, CO2, Cl2O3, Al2O3 – выберите основные, кислотные и амфотерные.
4. Какие соли относят к кислым, основным, средним, двойным, смешанным, комплексным?
5. Назовите следующие соединения: ZnOHCl, KHSO3, NaAl(SO4)2. К какому классу соединений они относятся?
6. Что называют основностью кислоты?
7. Из приведенных гидроксидов выберите амфотерные: Fe(OH)2, KOH, Al(OH)3, Ca(OH)2, Fe(OH)3, Pb(OH)2.
8. Что называют схемой реакции? Уравнением реакции?
9. Как называют числа, стоящие в уравнении реакции? Что они показывают?
10. Как перейти от схемы реакции к уравнению?
11. С какими веществами вступают во взаимодействие основные оксиды? Амфотерные оксиды? Кислотные оксиды?
12. С какими веществами вступают во взаимодействие основания?
13. С какими веществами вступают во взаимодействие кислоты?
14. С какими веществами вступают во взаимодействие соли?
15. Определите массовые доли элементов в азотной кислоте HNO3.
16. Какие металлы взаимодействуют с щелочами?
17. Какие металлы взаимодействуют с растворами серной и соляной кислот?
18. Какие продукты образуются при взаимодействии металлов с азотной кислотой различной концентрации?
19. Какие реакции называют реакциями разложения? Соединения? Замещения? Окислительно-восстановительными?
20. Составьте уравнения реакций: CrCl3 + NaOH→; CrCl3 + 2NaOH→; CrCl3 + 3NaOH→; CrCl3 + NaOH(избыток)→.
21. Составьте уравнения реакций: Al + KOH →; Al + KOH + Н2О →.
22. Что называют атомом? Химическим элементом? Молекулой?
23. Какие элементы относят к металлам? Неметаллам? Почему?
24. Что называют химической формулой вещества? Что она показывает?
25. Что называют структурной формулой вещества? Что она показывает?
26. Что называют количеством вещества?
27. Что называют молем? Что он показывает? Какое количество структурных единиц содержится в моле вещества?
28. Какие массы элементов указаны в Периодической системе?
29. Что называют относительными атомной, молекулярной массами? Как их определяют? Каковы их единицы измерения?
30. Что называют молярной массой вещества? Как ее определяют? Какова ее единица измерения?
31. Какие условия называют нормальными условиями?
32. Какой объем занимает 1 моль газа при н.у.? 5 моль газа при н.у.?
33. Из чего состоит атом?
34. Из чего состоит ядро атома? Какой заряд имеет ядро атома? Чем определяется заряд ядра атома? Чем определяется масса ядра атома?
35. Что называют массовым числом?
36. Что называют энергетическим уровнем? Сколько электронов расположено на отдельном энергетическом уровне?
37. Что называют атомной орбиталью? Как ее изображают?
38. Что характеризует главное квантовое число? Орбитальное квантовое число? Магнитное квантовое число? Спиновое квантовое число?
39. Какова связь между главным и орбитальным квантовыми числами? Между орбитальным и магнитным квантовыми числами?
40. Как называют электроны с 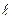 = 0?
= 0? 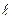 = 1?
= 1? 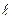 = 2?
= 2? 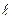 = 3? Сколько орбиталей соответствует каждому из данных состояний электрона?
= 3? Сколько орбиталей соответствует каждому из данных состояний электрона?
41. Какое состояние атома называют основным? Возбужденным?
42. Сколько электронов может располагаться на одной атомной орбитали? Чем они отличаются?
43. Октет электронов на внешней оболочке имеет Не+, S-2, C+4, O, F-, Cl+5.
44. Сколько и какие подуровни могут располагаться на первом энергетическом уровне? На втором? На третьем? На четвертом?
45. Сформулируйте принцип наименьшей энергии, правила Клечковского, принцип Паули, правило Хунда, периодический закон.
46. Что периодически изменяется для атомов элементов?
47. Что общего у элементов одной подгруппы? Одного периода?
48. Чем отличаются элементы главных подгрупп от элементов побочных подгрупп?
49. Составьте электронные формулы ионов Сr+3, Са+2, N-3. Какое количество неспаренных электронов имеют указанные ионы?
50. Какую энергию называют энергией ионизации? Сродством к электрону? Электроотрицательностью?
51. Как изменяются радиусы атомов и ионов в группе и в периоде Периодической системе Д.И. Менделеева?
52. Как изменяются электроотрицательности атомов в группе и в периоде Периодической системе Д.И. Менделеева?
53. Как изменяются металлические свойства элементов и свойства их соединений в группе и в периоде Периодической системе Д.И. Менделеева?
54. Составьте формулы высших оксидов алюминия, фосфора, брома, марганца.
55. Как определяется количество протонов, нейтронов и электронов в атоме?
56. Сколько протонов, нейтронов и электронов содержится в атоме цинка?
57. Сколько электронов и протонов содержится в ионах Сr+3, Са+2, N-3?
58. Сформулируйте закон сохранения массы? Что остается постоянным при протекании любой химической реакции?
59. Какой параметр остается постоянным в изобарных химических реакциях?
60. Сформулируйте закон постоянства состава. Для веществ какой структуры он справедлив?
61. Сформулируйте закон Авогадро и следствия из него.
62. Если плотность газа по азоту составляет 0,8, то какова молярная масса газа?
63. В случае изменения каких внешних параметров изменяется молярный объем газа?
64. Сформулируйте объединенный газовый закон.
65. Для равных объемов разных газов при одних и тех же условиях массы газов будут равны?
66. Сформулируйте закон Дальтона. Если общее давление смеси азота и водорода составляет 6 атм., а объемное содержание водорода 20%, то каковы парциальные давления компонентов?
67. Запишите уравнение Менделеева-Клапейрона (состояния идеального газа).
68. Какую массу имеет смесь газов, состоящая из 11,2 л азота и 11,2 л фтора (н.у.)?
69. Что называют химическим эквивалентом? Молярной массой эквивалента?
70. Как определяют молярные массы эквивалентов простых и сложных веществ?
71. Определите молярные массы эквивалентов следующих веществ: О2, Н2О, СаСl2, Са(ОН)2, Н2S.
72. Определите эквивалент Bi(OH)3 в реакции Bi(OH)3 + HNO3 = Bi(OH)2(NO3) + H2O.
73. Сформулируйте закон эквивалентов.
74. Что называют молярным объемов эквивалента вещества? Как его определяют?
75. Сформулируйте закон объемных отношений.
76. Какой объем кислорода потребуется на окисление 8 м3 водорода (н.у.) по реакции 2H2 + O2 ↔ 2H2O?
77. Какой объем хлороводорода образуется при взаимодействии 15 л хлора и 20 л водорода?
78. Что понимают под химической связью? Укажите характеристики химической связи.
79. Что является мерой прочности химической связи?
80. Что влияет на распределение электронной плотности?
81. Что определяет форму молекулы?
82. Что называют валентностью?
83. Определите валентности азота в следующих соединениях: N2, NH3, N2H4, NH4Cl, NaNO3.
84. Что называют степенью окисления?
85. Какую связь называют ковалентной?
86. Укажите свойства ковалентной связи.
87. Как изменяется полярность связи в ряду КI, КBr, КCl, КF?
88. Молекулы какого вещества неполярны: кислород, хлороводород, аммиак, уксусная кислота.
89. Что понимают под гибридизацией валентных орбиталей?
90. Определите типы гибридизации центральных атомов в следующих веществах: фторид бериллия, хлорид алюминия, метан.
91. Как влияет тип гибридизации на пространственное строение молекул?
92. Какую связь называют ионной? Под воздействием каких сил она возникает?
93. Какую связь называют металлической?
94. Какими свойствами обладают вещества с металлическим типом химической связи?
95. Чему равно максимальное число 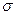 -связей, которое может образовываться между двумя атомами в молекуле?
-связей, которое может образовываться между двумя атомами в молекуле?
96. Как определяется абсолютная электроотрицательность атома элемента?
97. Расположите элементы в порядке возрастания их электроотрицательности: Fe, C, Ag, H, Cl.
98. Что называют дипольным моментом связи? Как его рассчитывают?
99. Какими особенностями обладают вещества с атомной кристаллической решеткой? С молекулярной кристаллической решеткой?
100.Какую связь называют водородной? От чего зависит ее прочность? Между молекулами каких неорганических веществ она возникает?
 2015-10-14
2015-10-14 573
573







