1. Что изучает термодинамика?
2. Что называют термодинамической системой? Какие виды систем существуют?
3. Что называют параметрами состояния? Какие параметры называют интенсивными, экстенсивными? Назовите основные параметры химической системы.
4. Что называют процессом? Самопроизвольным процессом? Циклом? Равновесным процессом? Неравновесным процессом? Обратимым процессом?
5. Что называют фазой? Гомогенной, гетерогенной системой?
6. Что называют функцией состояния?
7. Что характеризует внутренняя энергия U? От чего зависит внутренняя энергия?
8. Что называют теплотой Q? Какие реакции являются экзотермическими, эндотермическими? Как при их протекании изменяется теплота и энтальпия?
9. Что называют работой p∆V?
10. Сформулируйте первый закон термодинамики. Запишите его математически.
11. Сформулируйте первый закон термодинамики для изотермического, изохорного и изобарного процессов.
12. Что называют энтальпией?
13. Что называют тепловым эффектом реакции? От чего зависит тепловой эффект реакции?
14. Какое уравнение называют термодинамическим? Термохимическим?
15. Какие условия называют стандартными?
16. Что называют энтальпией реакции? Стандартной энтальпией реакции?
17. Что называют энтальпией образования вещества? Стандартной энтальпией образования вещества?
18. Какое состояние вещества является стандартным? Чему равна энтальпия образования простого вещества в стандартном состоянии?
19. Энтальпия образования H2SO3 по величине равна тепловому эффекту реакции: H2(г) + S(тв) + 1,5О2(г) 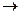 H2SO3(ж); H2(г) + SО2(г) + 0,5О2(г)
H2SO3(ж); H2(г) + SО2(г) + 0,5О2(г) 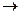 H2SO3(ж); H2О(г) + SО2(г)
H2SO3(ж); H2О(г) + SО2(г) 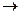 H2SO3(ж); 2H(г) + S(тв) + 3О(г)
H2SO3(ж); 2H(г) + S(тв) + 3О(г) 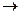 H2SO3(ж).
H2SO3(ж).
20. При взаимодействии 1 моля водорода и 1 моля брома выделилось 500 кДж тепла. Чему равна ∆Нобр, HBr?
21. При образовании 5 молей вещества АхВу поглотилось 500 кДж тепла. Чему равна ∆Нобр этого вещества?
22. Что называют энтальпией сгорания? Стандартной энтальпией сгорания? Теплотворной способностью?
23. Сформулируйте закон Гесса, первое и второе следствия из него.
24. Какое выражение применимо для расчета ∆Нр реакции 2А + 3В 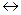 2С по следствию закона Гесса:
2С по следствию закона Гесса:
∆Нр = 2∆Нобр, С + 2∆Нобр, А + 3∆Нобр, В ; ∆Нр = 2∆Нобр, С – (2∆Нобр, А + 3∆Нобр, В);
∆Нр = 2∆Нобр, А + 3∆Нобр, В –2∆Нобр, С; ∆Нр = – 2∆Нобр, С – (2∆Нобр, А + 3∆Нобр, В)?
25. Стандартная энтальпия сгорания (∆Н0сгор) метанола СН4О(ж) (М = 32 г/моль) равна -726,6 кДж/моль. Какое количество тепла выделится при сгорании 2,5 кг вещества?
26. В каком случае стандартная энтальпия сгорания одного вещества равна стандартной энтальпии образования другого вещества?
27. Для каких веществ стандартная энтальпия сгорания равна нулю: СО, СО2, Н2, О2?
28. Для реакции 2Cl2(г) + 2H2O(ж) 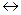 4HCl(г) + О2(г) рассчитайте стандартную энтальпию (кДж), если известны стандартные энтальпии образования веществ:
4HCl(г) + О2(г) рассчитайте стандартную энтальпию (кДж), если известны стандартные энтальпии образования веществ:
| Вещество | HCl | О2 | Cl2 | H2O |
∆Н 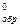 , кДж/моль , кДж/моль | -92,31 | -285,83 |
29. ∆Н 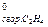 = -1410,97 кДж/моль; ∆Н
= -1410,97 кДж/моль; ∆Н 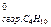 = -2877,13 кДж/моль. Какое количество теплоты выделится при совместном сжигании 2 моль этилена и 4 моль бутана?
= -2877,13 кДж/моль. Какое количество теплоты выделится при совместном сжигании 2 моль этилена и 4 моль бутана?
30. ∆Н 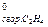 = -1410,97 кДж/моль; ∆Н
= -1410,97 кДж/моль; ∆Н 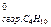 = -2877,13 кДж/моль. Какое количество теплоты выделится при сжигании 0,7 кг газовой смеси, состоящей из 20% этилена и 80% бутана?
= -2877,13 кДж/моль. Какое количество теплоты выделится при сжигании 0,7 кг газовой смеси, состоящей из 20% этилена и 80% бутана?
31. Стандартная энтальпия реакции MgCO3(тв) → MgO(тв) + СО2(г) равна 101,6 кДж; стандартные энтальпии образования MgO(тв) и СО2(г): -601,0 и -393,5 кДж/моль соответственно. Чему равна стандартная энтальпия образования карбоната магния MgСO3?
32. Что называют термодинамической вероятностью системы? Что называют энтропией? Как энтропия выражается через термодинамическую вероятность?
33. Сформулируйте второй закон термодинамики.
34. Что называют стандартной энтропией вещества?
35. Сформулируйте третье начало термодинамики (постулат Планка).
36. Что называют энтропией реакции? Стандартной энтропией реакции?
37. Какое выражение применимо для расчета ∆Sр реакции CH4 + CO2 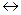 2CO + 2H2:
2CO + 2H2:
∆Sр = S 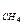 + S
+ S 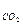 + S
+ S 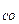 + S
+ S 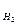 ; ∆Sр = S
; ∆Sр = S 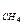 + S
+ S 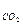 + 2S
+ 2S 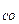 + 2S
+ 2S 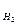 ;
;
∆Sр = 2S 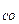 + 2S
+ 2S 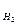 – S
– S 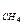 + S
+ S 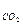 ; ∆Sр = 2S
; ∆Sр = 2S 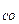 + 2S
+ 2S 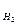 – S
– S 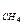 – S
– S 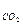 ?
?
38. Для реакции 2Cl2(u) + 2H2O(ж) 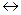 4HCl(г) + О2(г) рассчитайте стандартную энтропию (Дж/К), если известны стандартные энтропии образования веществ:
4HCl(г) + О2(г) рассчитайте стандартную энтропию (Дж/К), если известны стандартные энтропии образования веществ:
| Вещество | HCl | О2 | Cl2 | H2O |
| S0, Дж/моль·К | 186,79 | 205,04 | 222,98 | 70,08 |
39. Что называют свободной энергией Гиббса? Какова ее связь с другими термодинамическими функциями?
40. Как по знаку энергии Гиббса реакции определяют направление реакции?
41. При каких температурах возможна реакция, если ∆H<0, ∆S>0; ∆H<0, ∆S<0; ∆H>0, ∆S>0; ∆H>0, ∆S<0.
42. Как определяют равновесную температуру процесса?
43. Что называют энергия Гиббса реакции ∆Gр? Стандартной энергией Гиббса реакции?
44. Какое выражение применимо для расчета ∆Gр реакции 4NH3(г) + 5O2(г) 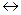 4NO(г) + 6H2О(ж)
4NO(г) + 6H2О(ж)
∆Gр = ∆G4 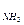 + ∆G5
+ ∆G5 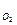 + ∆G4
+ ∆G4 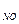 + ∆G6
+ ∆G6 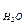 ; ∆Gр = ∆G
; ∆Gр = ∆G 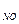 + ∆G
+ ∆G 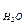 + ∆G
+ ∆G 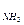 + ∆G
+ ∆G 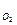 ;
;
∆Gр = 4∆G 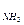 + 5∆G
+ 5∆G 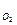 - 4∆G
- 4∆G 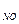 - 6∆G
- 6∆G 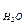 ; ∆Gр = 4∆G
; ∆Gр = 4∆G 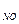 + 6∆G
+ 6∆G 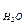 - 4∆G
- 4∆G 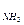 - 5∆G
- 5∆G 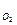 ?
?
45. Для реакции HNO3(ж) + HNO2(ж) 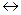 2NO2(г) + H2O(ж) рассчитайте стандартную энергию Гиббса (кДж), если известны стандартные энергии Гиббса образования веществ:
2NO2(г) + H2O(ж) рассчитайте стандартную энергию Гиббса (кДж), если известны стандартные энергии Гиббса образования веществ:
| Вещество | NO2 | H2O | HNO3 | HNO2 |
| ∆G0, кДж/моль | 51,5 | -237,2 | -80,8 | -55,6 |
46. Для реакции Fe(тв) + Al2O3(тв) → Al(тв) + Fe2O3(тв) определите равновесную температуру и возможность протекания процесса при 1250С, если ∆Н 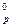 = 853,8 кДж/моль; ∆S
= 853,8 кДж/моль; ∆S 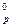 = 37,68 Дж/моль·K.
= 37,68 Дж/моль·K.
47. Что понимают под скоростью химической реакции?
48. Сформулируйте закон действующих масс.
49. За 40 с в результате двух реакций Zn + 2HCl = ZnCl2 + H2 (1) и Zn + 2HBr = ZnBr2 + H2 (2) образовалось по 8 г хлорида и бромида цинка. Сравните скорости реакций.
50. Если в реакции 3Fe(NO3)2(р-р) + 4HNO3 = 3Fe(NO3)3(р-р) + NO(г) + 2H2O(ж) концентрацию Fe(NO3)2 увеличить в 7 раза, а концентрацию HNO3 в 4 раза, то как изменится скорость реакции?
51. Составьте кинетическое уравнение реакции Sb2S3(тв) + 3Н2(г) 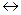 2Sb(тв) + 3H2S(г).
2Sb(тв) + 3H2S(г).
52. Как определяется скорость многостадийной реакции?
53. Как изменится скорость прямой реакции СО(г) + 3Н2(г) 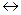 СН4(г) + Н2О(г) при увеличении давления системы в 3 раза?
СН4(г) + Н2О(г) при увеличении давления системы в 3 раза?
54. Что называют константой скорость? От чего она зависит?
55. Что называют энергией активации? От чего она зависит?
56. Константа скорости некоторой реакции при температуре 310 К равна 4,6∙10-5 л·моль-1·с-1, а при температуре 330 К 6,8∙10-5 л·моль-1·с-1. Чему равна энергия активации равна?
57. Энергия активации некоторой реакции равна 250 кДж/моль. Как изменится константа скорости при изменении температуры проведения реакции от 320 К до 340 К?
58. Запишите уравнение Аррениуса и правило Вант-Гоффа.
59. Энергия активации реакции (1) равна 150 кДж/моль, энергия активации реакции (2) равна 176 кДж/моль. Сравните константы скорости k1 и k2.
60. Чем объяснить повышение скорости реакции с повышением температуры?
61. Что называют температурным коэффициентом реакции?
62. Чему равен температурный коэффициент реакции, если константа скорости некоторой реакции при 283 и 308 К составляет соответственно 1,77 и 7,56 л·моль-1·с-1?
63. При температуре 350 К реакция закончилась за 3 с, а при температуре 330 К – за 28 с. За какое время она закончится при температуре 310 К?
64. Как влияет энергия активации на температурный коэффициент реакции?
65. Что называют катализатором? Ингибитором? Промотором? Каталитическим ядом?
66. Что называют химическим равновесием? До каких пор в системе сохраняется равновесное состояние?
67. Как связаны скорости прямой и обратной реакций в момент равновесия?
68. Что называют константой равновесия? От чего она зависит?
69. Выразите константу равновесия реакций 2NO + O2 ↔ 2NO2; Sb2S3(тв) + 3Н2 ↔ 2Sb(тв) + 3Н2S(г).
70. При некоторой температуре константа равновесия реакции N2O4 ↔ 2NO2 равна 0,16. В исходном состоянии NO2 не было, а равновесная концентрация NO2 составила 0,08 моль/л. Чему будут равны равновесная и исходная концентрация N2O4?
71. Сформулируйте принцип Ле Шателье. Как влияют на смешение равновесия изменение температуры, концентрации, общего давления?
72. Химическое динамическое равновесие в системе установилось при 1000 К и давлении 1 атм., когда в результате реакции Fe(тв) + СО2(г) ↔ FeO(тв) + СО(г) парциальное давление углекислого газа стало равно 0,54 атм. Чему равна константа равновесия Кр этой реакции?
73. Равновесные концентрации (моль/л) компонентов газофазной системы, в которой происходила реакция
3N2H4 ↔ 4NH3 + N2, равны: [N2H4]=0,2; [NH3]=0,4; [N2]=0,25. Чему равна константа равновесия обратимой
реакции?
74. Равновесные концентрации (моль/л) компонентов газофазной системы, в которой происходит реакция
N2 + 3H2 ↔ 2NH3, равны: [N2]=0,12; [H2]=0,14; [NН3]=0,1. Определите исходные концентрации N2 и H2.
75. Равновесные концентрации компонентов газовой фазы системы, в которой происходит реакция
С(тв) + СО2 ↔ 2СО при 1000 К и Робщ = 1 атм., равны CО2 - 17% об. и СО - 83% об. Чему равна константа
равновесия реакции?
76. Константа равновесия Кс обратимой газофазной реакции СН4 + Н2О ↔ СО + 3Н2 при некоторой температуре равна 9,54 моль2·л-2. Равновесные концентрации метана и воды равны соответственно 0,2 моль/л и 0,4 моль/л. Определите равновесные концентрации СО и Н2.
77. Запишите взаимосвязь константы равновесия Кр и энергии Гиббса ∆G обратимой реакции, протекающей в изотермических условиях.
78. Определите константа равновесия Кр газофазной обратимой реакции COCl2 ↔ CO + Cl2; ∆H0 = 109,78 кДж,
∆S0 = 136,62 Дж/К при 900 К.
79. Константа равновесия Кр газофазной реакции PCl3 + Cl2 ↔ PCl5; ∆Н0 = -87,87 кДж при 450 К равна 40,29 атм-1. Определите энергия Гиббса этого процесса (Дж/К).
80. Запишите связь между Кр и Кс обратимой газофазной реакции 2СО + 2Н2 ↔ СН4 + СО2.
 2015-10-14
2015-10-14 1090
1090
