Первый закон термодинамики является частным случаем закона сохранения энергии применительно к процессам, в которых выделяется, поглощается или преобразуется тепловая энергия.
Рассмотрим, как изменяется внутренняя энергия ∆U при проведении процесса, в котором система (газ, находящийся при постоянном давлении р =const в цилиндре под поршнем) (рис. 3.1), получает некоторое количество тепловой энергии Q р, в результате чего газ нагревается (Т 2> T 1, U 2> U 1) и расширяется (V 2> V 1).
Если положение поршня не зафиксировано, то поршень будет перемещаться до тех пор, пока внешняя сила F (F = p.s), приложенная к поршню, не уравновесит силу, действующую на поршень со стороны системы. Тогда имеем
F = p.s,
где p – внешнее давление, s – площадь поперечного сечения цилиндра.

Рис. 3.1. К выводу первого закона термодинамики
При этом движении совершается работа против сил внешнего давления, равная
A = F . ∆h,
где ∆h – величина перемещения поршня.
Поскольку произведение площади поперечного сечения цилиндра на величину перемещения поршня есть приращение объема системы ∆V, то можно записать
|
|
|
| A = F.∆h = р. s. ∆h = p.∆V. |
Тепловая энергия, сообщенная газу, при постоянном давлении Q р идет частично на увеличение внутренней энергии ∆U, а частично на производство работы A (при p =const):
− Q p= ∆U + A = ∆U + p∆V. (3.1)
Данное уравнение представляет собой термохимическую запись. Знак минус перед теплотой (− Q p) в уравнении (3,1) соответствует теплоте, подведенной к системе.
Уравнение (3.1) является аналитическим выражением первого закона термодинамики: количество теплоты, сообщенное системе, расходуется на увеличение ее внутренней энергии и на совершение системой работы.
Учитывая, что ∆U = U 2− U 1, а ∆V = V 2− V 1, уравнение (3.1) запишется в виде:
− Q р= U 2− U 1+ р (V 2− V 1)=(U 2+ рV 2)−(U 1+ рV 1)= Н 2− Н 1= ∆Н. (3.2)
Сумма внутренней энергии и произведения давления на объем (H = U + pV) получила название энтальпии (∆Н) или энергосодержания. Энтальпия является функцией состояния.
Свойства энтальпии:
1. Разность энтальпий системы в конечном и начальном состояниях не зависит от пути перехода системы из одного состояния в другое.
2. Энтальпия системы равна сумме энтальпий частей, составляющих систему, т.е. энтальпия − величина аддитивная.
3. Абсолютное значение энтальпии системы является принципиально неопределяемым.
Поэтому обычно пользуются относительными значениями энтальпий ∆Н, причем за точку отсчета принимают значение энтальпии образования простых веществ при 298 К (25оС), давлении 101,3 кПа (1атм), если они при этих условиях, называемых стандартными, находятся в устойчивом состоянии.
|
|
|
Стандартные энтальпии образования всех простых веществ, устойчивых в стандартном состоянии, равны нулю. Например, ∆Н о298,Н2(газ)=0 кДж/моль.
Энтальпия сложного вещества − стандартная энтальпия образования, которая равна количеству теплоты с обратным знаком, выделяющейся или поглощающейся при образовании одного моля вещества из простых веществ, находящихся в устойчивых агрегатных состояниях в стандартных условиях.
Стандартные энтальпии образования определены для большого числа веществ и сведены в таблицы термодинамических величин (см. Прил. Табл. 2), измеряются в кДж/моль.
Для расчета энтальпий в нестандартных условиях (например, р =101,3 кПа, Т  298 К) используют зависимость энтальпии от температуры (рис. 3.2).
298 К) используют зависимость энтальпии от температуры (рис. 3.2).
В пределах одного фазового состояния (газового, жидкого и т.д.) изменение энтальпии при изменении температуры невелико, но при фазовых переходах изменение энтальпии происходит скачкообразно на величину соответственно теплоты плавления ∆Н пл или парообразования (кипения) ∆Н кип, взятых с обратным знаком.
Уравнение температурной зависимости энтальпии моля вещества в пределах одного фазового состояния:
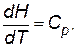
где Сp – мольная теплоемкость при постоянном давлении, которая равна количеству теплоты, необходимому для нагревания 1 моля вещества на один градус.

Рис. 3.2. Зависимость энтальпии образования вещества
от температуры
Ср зависит от природы и агрегатного состояния вещества, а также от температуры. Однако в небольшом температурном интервале зависимостью Ср от температуры можно пренебречь и считать, что ∆Н = Ср · ∆Т. С помощью этого соотношения можно рассчитать энтальпии веществ для различных температур (в пределах одного агрегатного состояния).
 2015-10-22
2015-10-22 11302
11302
