Термодинамическими методами невозможно найти абсолютные значения энтальпий и внутренних энергией, а можно определить только их изменения. В то же время при термодинамических расчетах химически реагирующих систем удобно использовать единую систему отсчета. При этом, поскольку энтальпия и внутренняя энергия связаны между собой соотношением 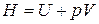 , то достаточно ввести систему отсчета лишь для одной энтальпии. Кроме того, для сравнения и систематизации тепловых эффектов химических реакций, которые зависят от физического состояния реагирующих веществ и от условий протекания ХР, вводится понятие стандартного состояния вещества. По рекомендации комиссии по термодинамике Международного союза теоретической и прикладной химии (ИЮПАК) в 1975 году стандартное состояние определено следующим образом:
, то достаточно ввести систему отсчета лишь для одной энтальпии. Кроме того, для сравнения и систематизации тепловых эффектов химических реакций, которые зависят от физического состояния реагирующих веществ и от условий протекания ХР, вводится понятие стандартного состояния вещества. По рекомендации комиссии по термодинамике Международного союза теоретической и прикладной химии (ИЮПАК) в 1975 году стандартное состояние определено следующим образом:
«Стандартным состоянием для газов является состояние гипотетического идеального газа при давлении в 1 физическую атмосферу (101325 Па). Для жидкостей и твердых веществ стандартным состоянием является состояние чистой жидкости или соответственно чистого кристаллического вещества при давлении в 1физическую атмосферу. Для веществ в растворах за стандартное состояние принято гипотетическое состояние, при котором энтальпия одномолярного раствора (1 моль вещества в 1 кг растворителя) равнялась бы энтальпии раствора при бесконечном разбавлении. Свойства веществ в стандартных состояниях обозначаются надстрочным индексом 0». (Чистым веществом называется вещество, состоящее из одинаковых структурных частиц (атомов, молекул и др.)).
В этом определении говориться о гипотетических состояниях газа и растворенного вещества, поскольку в реальных условиях состояния газов в большей или меньшей степени отличаются от идеального, а состояния растворов - от идеального раствора. Поэтому при использовании термодинамических свойств веществ в стандартных состояниях для реальных условий вводятся поправки на отклонение этих свойств от реальных. Если эти отклонения невелики, то поправки можно не вводить.
В справочниках термодинамические величины обычно приводятся при стандартных условиях: давлении р 0=101325Па и температуре Т 0=0К или Т 0=298,15К (250С). При создании таблиц полных энтальпий веществ за начало отсчета энтальпий также было принято их стандартное состояние при температуре Т 0=0К или Т 0=298,15К.
У веществ, являющихся чистыми химическими элементами в наиболее устойчивом фазовом состоянии при р 0=101325Па и температуре начала отсчета энтальпий Т0, принимают значение энтальпий, равное нулю: 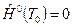 . (Например, для веществ в газообразном состоянии: О2, N2, H2, Cl2, F2 и др., для С (графит) и металлов (твердые кристаллы)).
. (Например, для веществ в газообразном состоянии: О2, N2, H2, Cl2, F2 и др., для С (графит) и металлов (твердые кристаллы)).
Для химических соединений (СО2, Н2О и др.) и для веществ, которые, являясь чистыми химическими элементами, не находятся в наиболее устойчивом состоянии (O, N и др.) энтальпия при р 0=101325Па и Т 0 не равна нулю: 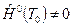 .
.
Энтальпия химических соединений при р 0 и Т 0 полагается равной тепловому эффекту образования их из чистых химических элементов при этих параметрах, т.е. 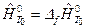 . Так, при Т0=0К:
. Так, при Т0=0К: 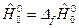 и при Т0=298,15К:
и при Т0=298,15К: 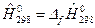 .
.
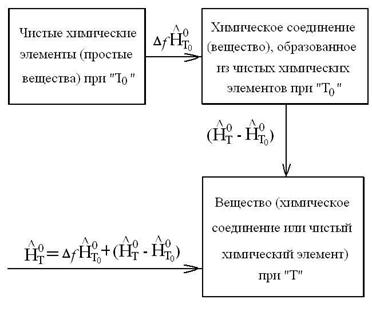
Энтальпия любого вещества при температуре Т будет равна количеству теплоты, которое необходимо подвести в изобарном процессе, чтобы из чистых химических элементов при температуре Т 0 получить данное вещество и нагреть его от температуры Т 0 до температуры Т, т.е. формула для расчета энтальпии любого вещества имеет вид:
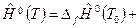
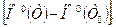 , или при более компактной записи имеем:
, или при более компактной записи имеем:
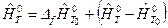 ,
,
где верхний индекс «о» означает, что вещество находится в стандартном состоянии при р 0=101325Па; 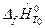 - энтальпия образования вещества при температуре Т 0 из чистых химических элементов;
- энтальпия образования вещества при температуре Т 0 из чистых химических элементов; 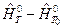 =
= 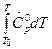 – избыточная энтальпия, связанная с теплоемкостью вещества,
– избыточная энтальпия, связанная с теплоемкостью вещества, 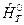 - полная энтальпия, учитывающая энтальпию образования вещества.
- полная энтальпия, учитывающая энтальпию образования вещества.
Для Т 0 = 0:
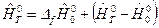 ,
,
Для Т = 298,15 К:
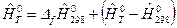 или
или 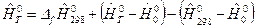 ,
,
Схема расчета энтальпии при температуре Т может быть представлена в виде:
В справочнике для различных индивидуальных веществ представлены величины: 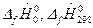 и избыточная энтальпия
и избыточная энтальпия 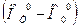 для различных температур Т.
для различных температур Т.
Так как избыточная энтальпия 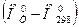 в таблицах индивидуальных веществ не приводится, то к левой части выражения для
в таблицах индивидуальных веществ не приводится, то к левой части выражения для 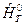 при Т 0=298,15К необходимо прибавить и вычесть теплоту образования вещества
при Т 0=298,15К необходимо прибавить и вычесть теплоту образования вещества 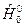 при температуре Т 0=0К. Тогда получим избыточную энтальпию
при температуре Т 0=0К. Тогда получим избыточную энтальпию 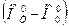 , которая приводится в таблицах, и дополнительный член
, которая приводится в таблицах, и дополнительный член 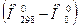 , равный разности теплот образования при температурах Т 0=298К и Т 0=0К; т.е.
, равный разности теплот образования при температурах Т 0=298К и Т 0=0К; т.е. 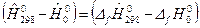 . Тогда имеем:
. Тогда имеем:
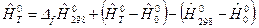
Полные энтальпии, рассчитанные с использованием соотношений для Т 0=0К и Т 0=298,15К имеют одинаковые численные значения для данного вещества при данной температуре Т.
 2015-01-21
2015-01-21 5981
5981
